
COSMOSIL 5HIC
コスモシール 5HIC は酵素をはじめとするタンパク質の分離に適した疎水クロマトグラフィー用カラムです。タンパク質の疎水クロマトグラフィーは、広く知られていますように、原則として有機溶媒を使用せず、緩衝液の濃度変化によって分離を行う手法であり、タンパク質を非常に穏やかな条件で分離できることから、酵素活性や三次構造を損なうことが少ない手法とされています。
特長
- 疎水性の違いで分離
- 酵素活性や三次構造を損なわずに分離
製品説明
物性
| 充填剤名称 | HIC |
|---|---|
| シリカゲル | 全多孔性球状高純度シリカゲル |
| 平均粒子径(µm) | 5 |
| 平均細孔径(nm) | 30 |
| 比表面積(m2/g) | 150 |
| 主な相互作用 | 疎水性 |
製品使用例
分析例
標準タンパク質の分離
疎水性クロマトグラフィーにおいては 1.0 〜 2.0 mol/L の硫酸アンモニウムを含む緩衝液を初期溶離液として、タンパク質を充填剤に吸着させた後、徐々に塩濃度を下げて疎水性の低いタンパク質から順に充填剤から脱離させてカラムから溶出させます。下記の分離例では、ミオグロビンは、塩濃度が高い条件下においても早く溶出し、後に溶出する BSA よりも相対的に固定相との相互作用が小さいタンパク質であることが示唆されます。
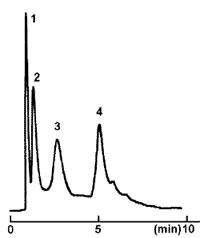
| Conditions | |||
|---|---|---|---|
| Column | COSMOSIL 5HIC 4.6 mm I.D. × 50 mm | Detection | UV 220 nm |
| Mobilephase | A : 20 mmol/L Phosphate Buffer+100 mmol/L Na2SO4 + 1.5 mol/L (NH4)2SO4(pH 6.0) B : 20 mmol/L Phosphate Buffer+100 mmol/L Na2SO4(pH 6.7) B conc. 0 → 100% 10 min Linear gradient |
Sample |
|
| Flow rate | 1.0 mL/min | ||
| Temperature | 30℃ | ||
粗 β-Glucosidase の分離
5HIC カラムで粗製のタンパク質を分離する時は硫酸アンモニウム濃度を 2.0 〜 0 mol/L の間で使用しますが、さらに相互分離を改善させるためには、グラジエント時間をより長くすることで相互分離を高めることが可能となると考えられます。
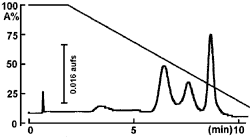
| Conditions | |||
|---|---|---|---|
| Column | COSMOSIL 5HIC 4.6 mm I.D. × 50 mm | Detection | UV 220 nm |
| Mobilephase | A : 20 mmol/L Phosphate Buffer+100 mmol/L Na2SO4 + 2.0 mol/L (NH4)2SO4(pH 6.0) B : 20 mmol/L Phosphate Buffer + 100 mmol/L Na2SO4(pH 6.7) B conc. 0 → 100% 10 min Linear gradient |
Sample | β-Glucosidase (15 µg) |
| Flow rate | 1.0 mL/min | ||
| Temperature | 30℃ | ||
関連資料
価格表
分析カラム(粒子径 5µm)
※価格表に記載のないカラムサイズをご要望の際はお問い合わせください
COSMOSIL / コスモシールはナカライテスク株式会社の登録商標です。
※掲載内容は予告なく変更になる場合があります。


