
COSMOSIL C18-OPN
現在、オープンクロマトグラフィーでは順相条件での分離が主流となっています。しかし高速液体クロマトグラフィー(HPLC)では逆相条件での使用が中心であり、オープンカラムクロマトグラフィーにおいても逆相系充填剤が用いられるようになってきました。しかし、従来の逆相系充填剤は展開溶媒の水濃度が 30 〜 50% になると充填剤が展開溶媒になじまなくなり、極端な場合には充填剤が浮き上がる現象が起こるため、使用する展開溶媒の水濃度に著しい制限を受けました。 コスモシール C18-OPN 充填剤はこの制限を全く受けず、水 100% でも浮き上がることなく使用できる、弊社独自のオープンカラムクロマトグラフィー用の浸水型逆相充填剤です。
製品説明
特性
コスモシール C18-OPN 充填剤は、図 1 に示したように C18 充填剤の外側表面を親水性化し、極性の高い展開溶媒との親和性を向上させ、かつ充填剤の細孔内部のオクタデシル基の疎水性によって、疎水性相互作用による逆相分配型の分離を達成させる浸水型の逆相充填剤です。
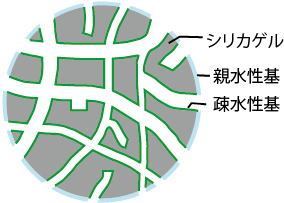
図 1. コスモシール C18-OPN 充填剤の構造

図 2. 充填剤に水を加えた写真
左のボトル : C18-OPN 水になじみ沈みます。
オープン・フラッシュクロマトグラフィーで低い有機溶媒濃度で使用できます。
右のボトル : C18-PREP 水になじまず浮き上がります。
オープン・フラッシュクロマトグラフィーでは有機溶媒濃度 70% 以上でご使用ください。
粒子径の比較
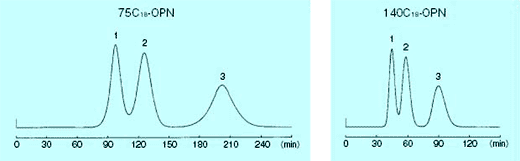
コスモシール C18-OPN は、75、140 µm 2 種類の粒子径をご用意しています。粒子径の違いによりピークの鋭さや、流速は異なりますが、溶出挙動は同じです。用途にあった粒子径を選択してください。
| Conditions | |||
|---|---|---|---|
| Column size | 10 mm I.D. × 250 mm | Sample |
|
| Mobile phase | Methanol / H2O = 20 / 80 | ||
| Temperature | Room temperature | ||
| Detection | UV 254 nm | ||
75 µm と 140 µm の比較
| Particle size (µm) |
Flow rate (mL/min) |
Theoretical plate number | Rs | Separation time (min) |
Solvent concentration (mL) |
|||
|---|---|---|---|---|---|---|---|---|
| TB | TP | CF | TB/TP | TP/CF | ||||
| 75 | 0.25 | 400 | 390 | 340 | 1 | 1.74 | 240 | 60 |
| 140 | 0.6 | 300 | 280 | 260 | 0.9 | 1.4 | 100 | 60 |
流速について
逆相クロマトグラフィーでは一般にメタノール、水などの粘度の高い溶媒を用いるため、粘度の低いヘキサン、酢酸エチルなどを用いる順相クロマトグラフィーよりも流速は遅くなります。さらに逆相クロマトグラフィーでは展開溶媒の組成の変化によって流速は大きく変化します。図 2 にメタノール- 水系展開溶媒の組成と流速の関係を示しました。高流速型の 140 µm では高分離型 75 µm の約 2.5 倍の流速が得られます。
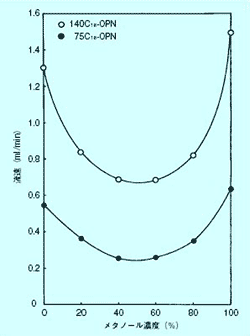
図 2. メタノール- 水系展開溶媒の組成と流速の関係
Column size : 10 mm I.D. × 180 mm、gravitational liquid flow
順相との比較
順相、逆相条件での分離(p-クレゾール・p-エチルフェノールの分離)
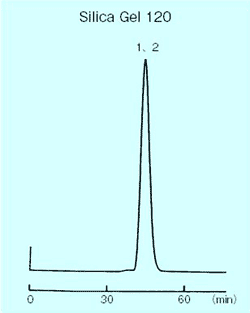
p-クレゾール、p-エチルフェノールはメチレン基 1 個の構造差であり、シリカゲル順相条件での分離は非常に困難ですが、疎水性相互作用を主とする逆相条件では容易に分離することができます。以下の図はシリカゲルでの順相分離とコスモシール C18-OPN 充填剤での逆相分離の比較例ですが、コスモシール C18-OPN 充填剤では完全に分離できます。 溶出時間はシリカゲル順相よりも長くかかっていますが、これはメタノール- 水系溶媒のため粘度が高く流速が遅いためであり、分離に必要な溶媒量は約 20 mL と順相条件の溶出容量約 40 mL の 1/2 となっています。
| Conditions | |||
|---|---|---|---|
| Packing material | Silica Gel 120(150 〜 325 mesh) | Flow rate | 0.7 mL/min |
| Column size | 10 mm I.D. × 180 mm | Temperature | Room temperature |
| Mobile phase | n-Hexane : ethyl acetate = 90 : 10 | Detection | UV 254 nm |
| Sample |
|
||
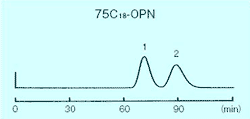
| Conditions | |||
|---|---|---|---|
| Packing material | COSMOSIL 75C18-OPN | Flow rate | 0.2mL/min |
| Column size | 10 mm I.D. × 180 mm | Temperature | Room temperature |
| Mobile phase | Methanol / H2O = 60 / 40 | Detection | UV 254nm |
| Sample |
|
||
カラムサイズと充填剤量
カラムサイズと必要なおよその C18-OPN 充填剤量
| Column(mm I.D.) | ベッド高(mm) | Amount of C18-OPN (g) |
|---|---|---|
| 10 | 150 | 4 |
| 250 | 7 | |
| 20 | 150 | 17 |
| 250 | 28 | |
| 30 | 150 | 38 |
| 250 | 63 |
使用方法
再生方法
コスモシール C18-OPN 充填剤はテトラヒドロフランやクロロホルムのような溶出力の強い溶媒で洗浄することによって充填剤に吸着した不純物を除去することができます。また、洗浄後再使用した場合でも再現性が良好で、繰り返し使用することができます。
(注意) シリカゲルを溶解するような高い pH(pH 7 以上)、あるいは C18 固定相の化学結合が切断されるような低い pH(pH 2 以下)での洗浄は避けてください。洗浄後の充填剤の乾燥は 50℃ 以下にしてください。
製品使用例
逆相条件での分離(テオブロミン・テオフィリンの分離)
テオブロミン、テオフィリンをオープンクロマトグラフィーで逆相分離する場合、十分な分離度を得るためには有機溶媒濃度を 50% 以下にしなければなりません。 このような水濃度が高い展開溶媒では、従来の逆相充填剤は浮き上がってしまい、分離に用いることができませんでした。 しかしコスモシール C18-OPN 充填剤では、図 1 に示したように水濃度 70% の展開溶媒でも使用可能となり、完全に分離することができます。
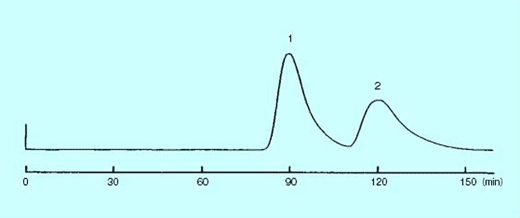
| Conditions | |||
|---|---|---|---|
| Packing material | COSMOSIL 75C18-OPN | Sample |
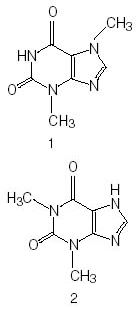 |
| Column size | 20 mm I.D. × 250 mm | ||
| Mobile phase | Methanol / H2O = 30 / 70 | ||
| Flow rate | 0.2 mL/min | ||
| Temperature | Room temperature | ||
| Detection | UV 254 nm | ||
使用文献
- Kodai T, Umebayashi K, Nakatani T, Ishiyama K, Noda N. Compositions of Royal Jelly II. Organic Acid Glycosides and Sterols of the Royal Jelly of Honeybees (Apis mellifera). Chemical & Pharmaceutical Bulletin. 2007;55(10):1528.
- Yang L, Hsu F, Chang S, Chen J, Hsu J, Hsu C, Liu P, Lin S. Phytochemistry. 2007;68(4):562-570.
- Anurakkun NJ, Bhandari MR, Kawabata J. α-Glucosidase inhibitors from Devil tree (Alstonia scholaris). Food Chemistry. 2007;103(4):1319-1323.
- Matsubara K, Saito A, Tanaka A, Nakajima N, Akagi R, Mori M, Mizushina Y. Epicatechin conjugated with fatty acid is a potent inhibitor of DNA polymerase and angiogenesis. Life Sciences. 2007;80(17):1578-1585.
- Kitamura M, Koyama T, Nakano Y, Uemura D. Characterization of a natural inducer of coral larval metamorphosis. Journal of Experimental Marine Biology and Ecology. 2007;340(1):96-102.
- He D, Matsunami K, Otsuka H, Shinzato T, Aramoto M, Bando M, Takeda Y. Tricalysiolide G and tricalysiols A and B: rearranged ent-kaurane-type and ent-kaurane-type diterpenoids from the leaves of Tricalysia dubia (Lindl.) Ohwi. Journal of Natural Medicines. 2007;61(1):46-50.
- Okamura T, Kikuchi T, Fukushi K, Arano Y, Irie T. A novel noninvasive method for assessing glutathione-conjugate efflux systems in the brain. Bioorganic & Medicinal Chemistry. 2007;15(9):3127-3133.
- Gao H, Nishida J, Saito S, Kawabata J. Inhibitory Effects of 5, 6, 7-Trihydroxyflavones on Tyrosinase. Molecules. 2007;12:86-97.
- Takakura Y, Tsukamoto H, Yamamoto T. Molecular Cloning, Expression and Properties of an α/s-Galactoside α2,3-Sialyltransferase from Vibrio sp. JT-FAJ-16. Journal of Biochemistry. 2007;142(3):403-412.
- Widyawaruyanti A, Subehan, Kalauni SK, Awale S, Nindatu M, Zaini NC, Syafruddin D, Asih PB, Tezuka Y, Kadota S. New prenylated flavones from Artocarpus champeden , and their antimalarial activity in vitro. Journal of Natural Medicines. 2007;31(4):410-413.
- Morimoto S, Tanaka Y, Sasaki K, Tanaka H, Fukamizu T, Shoyama Y, Shoyama Y, Taura F. Identification and Characterization of Cannabinoids That Induce Cell Death through Mitochondrial Permeability Transition in Cannabis Leaf Cells. J. Biol. Chem. 2007;282(28):20739-20751.
- Wang X, Gesang S, Jiao W, Liao X, Ding L. Two New Sesquiterpenoid Glucosides from the Aerial Parts of Saussurea involucrate. Journal of Integrative Plant Biology. 49(5), 2007, 609-614.
- Hou C, Chen Y, Wu J, Huang C, Wang S, Yang N, Shyur L. A Galactolipid Possesses Novel Cancer Chemopreventive Effects by Suppressing Inflammatory Mediators and Mouse B16 Melanoma. Cancer Research. 2007;67:6907-6915.
- Nishioka M, Tanioka Y, Miyamoto E, Enomoto T, Watanabe F. TLC Analysis of a Corrinoid Compound from Dark Muscle of the Yellowfin Tuna (Thunnus albacares). Journal of Liquid Chromatography & Related Technologies. 2007;30(15):2245-2252.
- Tsukamoto H, Takakura Y, Yamamoto T. Purification, Cloning, and Expression of an α/β-Galactoside α-2,3-Sialyltransferase from a Luminous Marine Bacterium, Photobacterium phosphoreum. J. Biol. Chem. 282(41):29794-29802.
価格表
| 製品名 | 製品番号 | 容量 | 価格 |
|---|---|---|---|
| COSMOSIL 75C18-OPN | 37842-66 | 100 g | |
| 37842-95 | 500 g | ||
| 37842-11 | 1 kg | ||
| COSMOSIL 140C18-OPN | 37878-16 | 100 g | |
| 37878-45 | 500 g | ||
| 37878-61 | 1 kg |
COSMOSIL / コスモシールはナカライテスク株式会社の登録商標です。
※掲載内容は予告なく変更になる場合があります。

