高純度SDS
SDS で変性した酵素タンパク質では、通常は構造が変化し、活性の低下、失活が起こります。この活性が回復しないのは、SDS 中に含まれる長鎖アルキルスルフェート(C14, C16)が原因です。これらの長鎖アルキルスルフェートはタンパク質とより強固に結合して簡単に除去できないため、結果として活性回復を阻害しています。弊社の「高純度 SDS」はアルキル成分として C12 が 99.5% 以上を保証していますので、不純物としての長鎖アルキルスルフェート(C14, C16)の含有はほとんどありません。この「高純度 SDS」を用いると SDS-PAGE 後でも、例えば Tris 系などのバッファー中で 1 ~ 2 時間処理することで結合している SDS を除去することができますので、活性が回復します。
- SDS-PAGE 後のゲルを用いて酵素活性を検出可能
顧客使用例
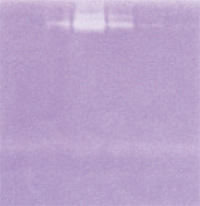
ゼラチンザイモグラフィーを用いた酵素活性の検出
| 高純度 SDS | 一般の SDS |
|---|---|
 |
 |
His-tag を付加したヒラメマトリックスメタロプロテアーゼ 9(MMP9)遺伝子を COS7 細胞に導入し、その培養上清の Ni-カラムからの溶出画分に存在する MMP9 のゼラチン分解活性をゼラチンザイモグラフィーを用いて検出しました。
反応条件
各溶出画分に SDS とグリセロールを加えたのち、ゼラチンを含む SDS ポリアクリルアミドゲルを用いて電気泳動をしました。泳動終了後、Triton X-100(2.5%)とNaCl(100 mM)を含む Tris-buffer 中で 1 時間放置し SDS を除去しました。続いて、37℃ で 16 時間インキュベートした後、CBB により染色しました。SDS ポリアクリルアミドゲル中のゼラチンが分解された部分は染色されません。
結果
同量の MMP9 を添加していますが、高純度 SDS を用いた方が強い酵素活性を示しています。一般の SDS では、酵素活性の回復が十分ではないことがわかります。(左 : アクリルアミドゲル作成およびサンプル調整に高純度 SDS を用いたもの、右 : 一般の SDS を用いたもの)
参考文献
- Lacks, S.A., Anal.Biochem. 100, 357 (1979).
- Bischoff, K.M., Anal.Biochem. 260, 1 (1998).
関連資料
価格表
※掲載内容は予告なく変更になる場合があります。