Dual Green Nucleic Acid Stain
本製品は、核酸電気泳動の検出に使用するアクリジンオレンジと 4',6-Diamidino-2-phenylindole(DAPI)の混合溶液です。UV 励起 / LED 励起共に検出可能で、さまざまなアプリケーションにも対応可能な自由度の高い染色剤です。
- UV 励起と LED 励起にて検出可能
- プレステインおよびポストステインで使用可能
- アガロースゲルおよびポリアクリルアミドゲルで使用可能
- 二本鎖 DNA、一本鎖 DNA および RNA 共に検出可能
製品説明
他社製品との比較
アガロースゲルにおいて、ポストステインおよびプレステイン法にて DNA の検出を行いました。本製品は他社製品と比較し、同等以上の性能を有しています。
UV 励起にて検出
| 染色方法 | ポストステイン | プレステイン | ||||
|---|---|---|---|---|---|---|
| 染色剤 | 本製品 | A 社 | B 社 | 本製品 | A 社 | B 社 |
| 染色像 | 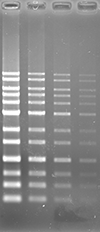 |
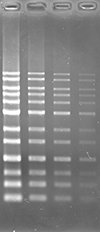 |
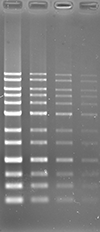 |
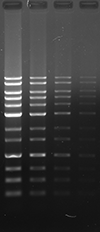 |
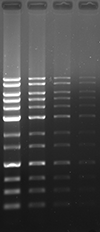 |
 |
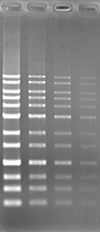
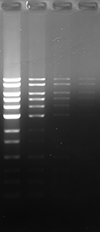
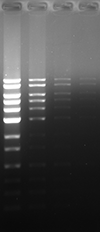
Blue LED 励起にて検出
| 染色方法 | ポストステイン | プレステイン | ||||
|---|---|---|---|---|---|---|
| 染色剤 | 本製品 | A 社 | B 社 | 本製品 | A 社 | B 社 |
| 染色像 | 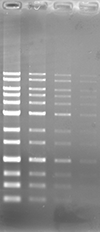 |
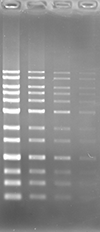 |
 |
 |
 |
 |
SYBR、Alexa Fluor はモレキュラー プローブス,インコーポレイテッドの登録商標です。
使用方法
(ポストステイン法)
- 精製水もしくは泳動用緩衝液を清潔なトレイ(Dispotray など)に加え、10,000 倍希釈になるように本製品を添加します。
- 1 で作製した染色液にゲルを入れ、15 ~ 30 分振とうし染色します。
- 染色液を捨て、精製水で軽くすすぎます(必要に応じて、精製水を用いて 30 分程度の脱色を行ってください)。
- トランスイルミネーターもしくは CCD イメージャーなどを用いて、下記波長にて観察します。
| 励起波長 | 蛍光波長 |
|---|---|
| 270、290、490 nm (UV 励起もしくは Blue LED 励起) |
526 nm (SYBR® フィルター) |
(プレステイン法)
- アガロース溶解後に本製品を 20,000 倍希釈になるように添加します。
- 本製品を添加したアガロースをゲルフレームに流し入れ、固化させます。
- その後は、通常通り電気泳動を行ってください(必要に応じて、泳動用緩衝液にも本製品 20,000 倍希釈になるように添加してください)。
- 電気泳動後、トランスイルミネーターもしくは CCD イメージャーなどを用いて、ポストステイン法 4 に記載の波長を用いて観察します。
製品使用例
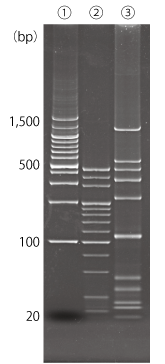
実施例 1 : ポリアクリルアミドゲルにおける本製品の使用例
Bullet PAGE One および自家調製ポリアクリルアミドゲルにおいて DNA および RNA マーカーを泳動し、本製品で検出を行いました。ポリアクリルアミドゲルにおいても本製品による検出が可能です。
※ポリアクリルアミドゲルにおけるプレステイン染色法は染色性が著しく低下するため推奨しません。
|
Bullet PAGE One による泳動 |
5% ポリアクリルアミドゲルによる泳動 |
|---|---|
 |
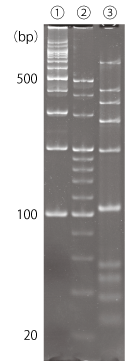 |
| サンプル | : | ① 100bp DNA Ladder One(Ready To Use)(#07908-75) 3 μL ② 20 bp DNA Ladder(タカラバイオ#3409A) 3 μL ③ siRNA Ladder Marker(タカラバイオ #3430) 3 μL |
||||
| ゲル | : | Bullet PAGE One Precast Gel, 5-15%, 13wells(#13079-84)、5% ポリアクリルアミドゲル(TBE 1 ×) | ||||
| 泳動用緩衝液、泳動 | : | [Bullet PAGE One] 泳動用緩衝液(10倍濃縮)(#30340-91)を 1 × に調製 400 V 定電圧 12 分 [5% ポリアクリルアミドゲル] トリス-ほう酸-EDTA 緩衝原液(#35440)を 1 × に調製 100 V 定電圧 56 分 |
||||
| 染色 | : | 泳動用緩衝液に本製品を 10,000 倍希釈になるように添加し、泳動後のゲルを入れ 15 分振とう(脱色なし) | ||||
| 検出 | : | ChemiDoc Touch MP(バイオ・ラッド ラボラトリーズ)(露光時間は AUTO にて検出) UV励起 SYBR® Greenモード(UV 透過、590 / 110 nm フィルターで検出) |
||||
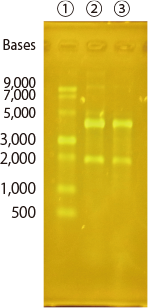
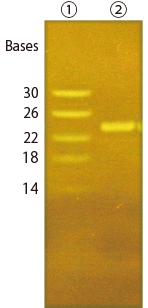
実施例 2 : 本製品を用いた RNA の検出例
変性アガロースゲルおよび変性ポリアクリルアミドゲルを用いて RNA を分離し、本製品で検出を行いました。本製品により RNA が検出できていることが分かります。
|
変性アガロースゲルによる泳動 |
変性ポリアクリルアミドゲルによる泳動 |
|---|---|
 |
 |
<変性アガロースゲルによる泳動>
| サンプル | : | ① ssRNA Ladder(ニュー・イングランド・バイオラボ #N0362S) 2 μL、 ② iPS 細胞抽出 RNA 0.4 μg ③ 心筋細胞抽出 RNA 0.4 μg |
||
| ゲル | : | 2.2 M ホルムアルデヒド含有 1.5% アガロースゲル(MOPS 1 ×) | ||
| 泳動用緩衝液 | : | MOPS 緩衝原液(10倍濃縮)(pH 7.0)、DEPC 処理済(23442-81)を 1 × に調製 | ||
| 泳動 | : | 50 V 定電圧 BPB がゲルの 3/4 程度になるまで泳動 | ||
| 染色 | : | MOPS(1 ×)に本製品を 10,000 倍希釈になるように添加し、泳動後のゲルを入れ 30 分振とう その後 30 分精製水にて脱色 | ||
| 検出 | : | Blue/Green LED イルミネーター(日本ジェネティクス #LB-16BG)にて励起、切り出し用オレンジボード(日本ジェネティクス #FAS-DGOF2)を用いて検出 デジタルカメラ(RICOH #CX4)にて撮影 | ||
<変性ポリアクリルアミドゲルによる泳動>
| サンプル | : | ① 14-30 ssRNA Ladder Marker(タカラバイオ #3416) 2.5 μL ② Micro RNA(hsa-miR-145-5p)(合成オリゴ一本鎖 RNA 23 bases) 25 pmol |
||
| ゲル | : | 8 M 尿素含有 15% ポリアクリルアミドゲル(TBE 0.5 ×) | ||
| 泳動用緩衝液、泳動 | : | トリス-ほう酸-EDTA 緩衝原液(#35440)を 0.5 × に調製 100 V 定電圧 56 分 | ||
| 染色 | : | 泳動用緩衝液に本製品を 10,000 倍希釈になるように添加し、泳動後のゲルを入れ 15 分振とう(脱色なし) | ||
| 検出 | : | Blue/Green LED イルミネーター(日本ジェネティクス #LB-16BG)にて励起、切り出し用オレンジボード(日本ジェネティクス #FAS-DGOF2)を用いて検出 デジタルカメラ(RICOH #CX4)にて撮影 | ||
実施例 3 : 本製品を用いた DNA サンプルの切り出し
本製品で検出した DNA を切り出し、それを鋳型として RNA 合成を行いました。本製品を用いて切り出した DNA においても RNA 合成が可能であり、また合成 RNA の確認も本製品で行うことができました。
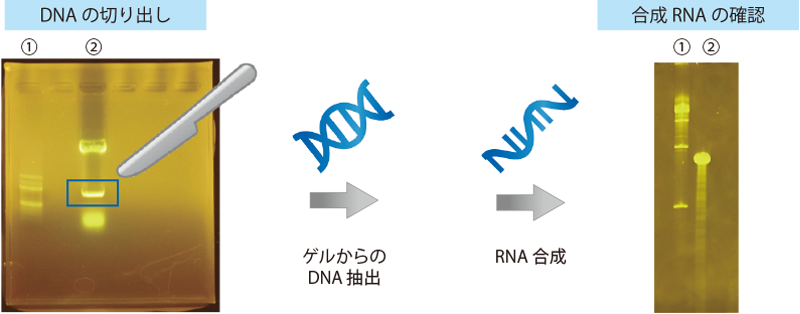
<DNA の切り出し>
| サンプル | : | ① 1kbp DNA Ladder One(Ready To Use)(#08232-85) 5 μL ② pQBI T7 GFP(BamH I と Bgl II で消化) 20 μg |
||
| ゲル | : | 1% アガロースゲル(TAE 1 ×)本製品を 20,000 倍希釈になるように添加 | ||
| 泳動用緩衝液、泳動 | : | トリス-酢酸-EDTA 緩衝原液(#35430)を 1 × に調製 100 V 定電圧 | ||
| 検出 | : | Blue/Green LED イルミネーター(日本ジェネティクス #LB-16BG)にて励起、切り出し用オレンジボード(日本ジェネティクス #FAS-DGOF2)を用いて検出 デジタルカメラ(RICOH #CX4)にて撮影 | ||
↓ [DNA の抽出] Gel Advanced Gel Extraction Miniprep System(Viogene #EG2001)を用いてゲルより DNA を抽出
↓ [RNA の合成] ScriptMAX® Thermo T7 Transcription Kit(東洋紡 #TSK-101)を用いて鋳型 DNA 0.1 μg より RNA を合成
<合成 RNA の確認>
| サンプル | : | ① ssRNA Ladder(ニュー・イングランド・バイオラボ #N0362S) 2 μL ② 合成した RNA 全量の 1/10 量 |
|||
| ゲル | : | 8 M 尿素含有 4% ポリアクリルアミドゲル(TBE 0.5 ×) | |||
| 泳動用緩衝液 | : | トリス-ほう酸-EDTA 緩衝原液(#35440)を 0.5 × に調製 | |||
| 染色 | : | TBE 0.5 × に本製品を 10,000 倍希釈になるように添加し、泳動後のゲルを入れ 30 分振とう(脱色なし) | |||
| 検出 | : | Blue/Green LED イルミネーター(日本ジェネティクス #LB-16BG)にて励起、切り出し用オレンジボード(日本ジェネティクス #FAS-DGOF2)を用いて検出 デジタルカメラ(RICOH #CX4)にて撮影 | |||
ScriptMAX は東洋紡株式会社の登録商標です。
顧客使用例
アガロースゲルにおいて、プレステイン方法にて DNA ラダーマーカーおよび PCR 産物の検出を行いました。
|
本製品および他社製品検出に適した励起 |
EtBr 検出に適した励起 |
|---|---|
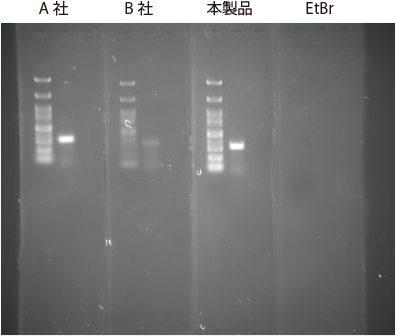 |
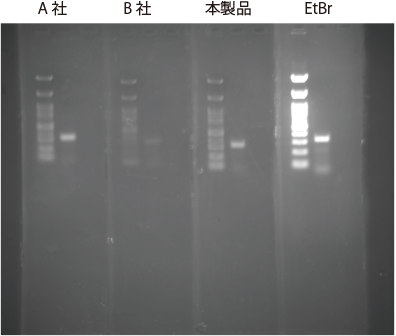 |
| サンプル | : | 左)100bp DNA ラダーマーカー 右)PCR 産物 |
||
| ゲル | : | 2% アガロースゲル 各染色剤を 20,000 倍希釈(EtBr は 0.5 μg/mL)になるように添加し、固化 | ||
| 検出 | : | FluorChem 8800(Alpha Innotech)(露光時間 1 秒) [本製品および他社製品検出に適した励起 / 蛍光波長] 302 nm / 537 nm [EtBr 検出に適した励起 / 蛍光波長] 302 nm / 595 nm |
||
【使用者の評価】 他社製品および EtBr と比較して遜色なく、同等かそれ以上の性能です。
価格表
※研究者の皆さまのご所属などは、データご提供時の情報に基づいています。
※掲載内容は予告なく変更になる場合があります。