【コラム】
免疫染色用の抗体選びに重要なポイント
免疫染色用の抗体選びに重要なポイント
抗体選びに重要なポイントはいくつかあり、特に以下の 7 つはとても大切です。
ここでは重要なポイントを 1 つずつ解説していきます。なお、染色する対象によって、細胞は Immunocytochemistry(ICC)、組織は Immunohistochemistry(IHC)と呼び、蛍光色素のついた抗体を用いる場合は Immunofluorescence (IF)と呼びます。
1. 反応性
調べようとしている細胞や組織の動物種に対応している抗体を選ぶ必要があります。
もし、目的サンプルの動物種において、市販されている抗体が無い場合は、別の動物種で市販されている抗体のエピトープと目的のサンプル動物種の配列(アミノ酸配列)を比較して、その抗体が使えるか予想を立てることが可能です。
2. 特異性
抗体が特定のターゲット上のエピトープを認識することができるかの能力になります。
この特異性は、翻訳後修飾や細胞内ドメイン、特定のアイソフォームを検出する場合にも役立ちます。例えば、有糸分裂マーカーの phospho-Ser10 Histone H3 を検出するために、Serine10 でリン酸化された Histone H3 だけを認識しなければなりません。
下図は HeLa 細胞中の Histone H3 を染色したものとなります(緑部分)。
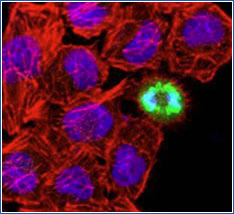
3. クローン性
抗体は、作製法とエピトープの認識数でモノクローナル抗体とポリクローナル抗体に分類されます。
| クローン | モノクローナル抗体 | ポリクローナル抗体 |
|---|---|---|
| 由来細胞 | 単一の抗体産生 B 細胞 | 多様な抗体産生 B 細胞 |
| 反応エピトープ | 常に単一エピトープのみ。 | 抗原が大きいものや全長タンパク質抗原の場合は、複数のエピトープに反応。単一のエピトープのみを抗原とする場合は、そのエピトープにのみ反応する。 |
| 交差反応性 | ほとんどないが、多種の生物に共通していると交差反応する可能性がある。 | 交差反応は起こりやすい。特に全長タンパク質抗原を利用して作製した場合はより起こりやすくなる。 |
| 使用濃度 | 1 ~ 15 µg/mL | 5 ~ 25 µg/mL |
4. 抗体作製動物(ホスト種)
ホスト種は抗体を作るときに使った動物種を指します。特に間接検出法の場合は慎重に抗体の組み合わせを選ばなければなりません。
例えば、多重染色の ICC を行う場合、一次抗体を全て同じホスト種にすると、色素のついている二次抗体が全部一色に染色してしまうので、必ず交差反応がないような別々のホスト種で作られた抗体を組み合わせなければなりません。
交差反応を低減するために、"Absorbed" という他の動物種の抗原に結合する抗体を排除した製品もあります(例:Absorbed against sheep, mouse, and rabbit)。もし多重染色においてホスト種の選択肢がない場合は、抗体のサブクラス(例:IgG1、IgG2b、IgG3 など)を選んで、二次抗体をその特定のサブクラスに対するものと組み合わせる方法もあります。
5. アプリケーション互換性
使用を検討している抗体が、これから行う実験に推奨されているか確認してください。
もし前例がない場合は、抗体濃度、抗体希釈液、反応時間・温度、二次抗体の濃度、ブロッキング剤など、重要なポイントを複数の条件に分けて一番良い結果が出るプロトコールを作る「条件検討」が必要です。
細胞や組織の染色には、タンパク質の形が変わったりしていない生体のままの形の「ネイティブ抗原」に反応する抗体が適しています。
6. 濃度と反応時間
5. でも示しましたが、抗体の濃度、希釈液、反応時間・温度などは、抗原抗体反応や非特異反応に影響します。
抗体購入時に添付されているデータシートに、推奨希釈濃度や反応時間の情報が掲載されています。参考文献の情報も役に立ちます。特に、抗原、細胞、組織に前処理が必要な場合もありますので、参考文献は必ず確認してください。
濃度と反応時間を一度に検証することは非常に難しいので、まずは反応時間を固定(例:室温 1 時間など)して、抗体の濃度を変えていく方法をお薦めします。条件検討するときは、必ずコントロール(陽性、陰性)、つまり、必ず結果が出るものと出ないものを置く必要があります。
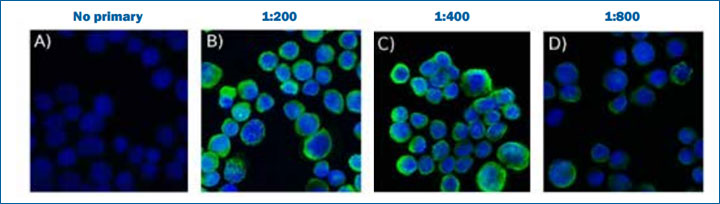
下図の通り一次抗体の濃度を変えるだけで、染色結果が異なってきます。
A はコントロールで一次抗体を加えていないものであり、二次抗体の非特異反応がないことを確かめるためのものです。B から D までは一次抗体を徐々に高い倍率で希釈しています。C) 1:400 では、すでにはっきり染色できていない部分が出てきており、D) 1:800 になるとほとんど染色できていません。
この結果から、抗体は B) 1:200 の濃度で使うのが適していると判断できます。
7. 抗体洗浄ステップ
一次抗体や二次抗体を反応させた後、洗浄して余分な抗体を除くステップがあります。下記の点にご注意ください。
- 十分に洗浄して取り除かなければ、非特異反応が多く、高いバックグラウンドが検出されたり、細胞が過剰に染色されたりしてしまいます。
- 洗浄の際に、サンプルを乾かさないように気を付けてください。
- 十分な洗浄といっても、洗浄液に漬け込んだままにすると細胞が壊れてしまいます。一般的には、0.1% Triton X-100 または 0.05% Tween 20 の PBS で 5 分の洗浄を繰り返すプロトコールが多く用いられています。
Triton はユニオン・カーバイド・コーポレーション、Tween はクローダ インターナショナル ピーエルシーの登録商標です。
関連コラム
※掲載内容 2020 年 9 月現在の情報に基づいています。

