【コラム】
免疫染色の抗体反応と検出
免疫染色の抗体反応と検出
「【コラム】免疫染色用の抗体選びに重要なポイント」で説明したように、免疫染色を行う際には、調べようとしているサンプルに対応した抗体を選択する必要があります。
サンプルを準備し、目的に合った抗体を選択できたら、いよいよ抗体反応と検出のステップに進みます。
抗体反応を活用した免疫染色実験には、膜に移したターゲットに対して反応を行うウェスタンブロッティング法や、溶液中に含まれるターゲットを捉える ELISA 法もありますが、ここでは細胞サンプル上でターゲットの存在位置を染め分け、顕微鏡下で観察する実験(免疫細胞染色(ICC)/ 免疫蛍光染色(IF))に焦点を絞って説明します。
また、細胞に含まれるターゲットの位置を検出する方法には、オートラジオグラフィー法やアッセイの感度向上を狙った酵素抗体法、免疫蛍光染色法などの方法が存在します。今回は、その中でも免疫蛍光染色の検出方法を紹介します。
直接法・間接法とは
免疫蛍光染色の検出では、抗体に結合した蛍光色素に対する励起波長の光を照射し、その蛍光により目的の抗原を検出します。この反応方法の違いで、直接法と間接法の 2 種類に分類されます(下図)。
蛍光色素が結合した一次抗体で目的の抗原を捉え、標識する方法を直接法と呼びます。一方、目的の抗原と結合する一次抗体と、一次抗体の定常領域に対して特異的に結合する標識二次抗体を段階的に使用する方法を間接法と呼びます。
直接法(左)と間接法(右)の概念図
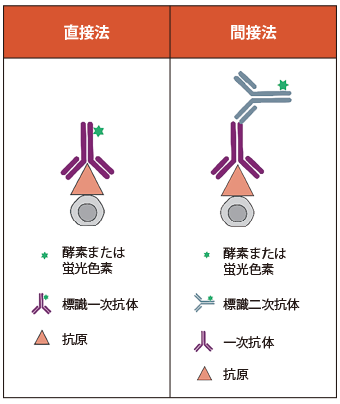
直接法・間接法の比較
直接法と間接法のどちらが適切かは、前後の実験条件や実験の目的によって変わります。以下に各項目における直接法と間接法の比較を示しましたので、お考えの実験条件でいずれかを選択ください。
| 直接法 | 間接法 | |
|---|---|---|
| 感度 | 二次抗体の結合によるシグナル増幅が起こらないため、感度は乏しくなります。 | 二次抗体が一次抗体に結合して増幅されるため、一次抗体のみを使用する直接法と比較すると感度に優れます。 |
| 検出までの時間 | 二次抗体を反応させ、洗浄するステップが無いため、短時間で済みます。 | 二次抗体を反応させ、洗浄するステップがあるため、直接法より時間を要します。 |
| 多重染色(複数反応の同時並行)の難易度 | 同じ動物種から作られた一次抗体は同時に使うことができるため、多重染色は容易に行えます。 | 二次抗体の交差反応性に依存するため、直接法に比べると多重染色は複雑になります。 |
| バックグラウンド | 二次抗体の交差反応性を気にする必要が無く、非特異的なバックグラウンドは低くて済みます。 | 二次抗体の交差反応性に依存することから、バックグラウンドは高い傾向にあります。 |
| 抗体選択の自由度 | ターゲットに対して直接反応できる抗体が限られているため、選択の自由度は低くなります。 | 実験に合わせて適切な二次抗体を選択できることから、選択の自由度は高くなります。 |
コントロール実験の必要性
ICC / IF で検出を行う際に問題となりやすいのが、バックグラウンドの染色です。いくつかの要因が、標的以外の領域での蛍光を高め、偽陽性をもたらします。非特異的なバックグラウンド染色の原因を特定するには、原因別に以下のようなコントロール実験をする必要があります。
| コントロールの種類 | 説明 |
|---|---|
| 自家蛍光のコントロール | 未染色のサンプル(固定、ブロッキング、透過処理は済みで染色前のもの)を用いて、サンプルが染色に適した状態に処理できているかどうかを確認します。 |
| 一次抗体抜きのコントロール | サンプルを固定、ブロッキング、透過処理後、一次抗体を加えず二次抗体のみとインキュベートさせたものを使用します(図 1)。 |
|
吸収コントロール |
吸収コントロールに使用するのは、抗体作成段階の免疫時に使用した元のペプチド抗原です。ブロッキングペプチドを事前に一次抗体と反応させるコントロール実験を行うことで、抗体の特異性を検証することができます。 |
| アイソタイプコントロール | アイソタイプコントロール抗体を使用します。アイソタイプコントロール抗体とは、特定の抗原と反応しない抗体のことです。実験で使用したい一次抗体と同じ動物種、アイソタイプ、標識物のアイソタイプコントロール抗体を使用して本番の実験と同じ条件で染色することで、ネガティブコントロールが得られます。 |
| 発現コントロール |
ポジティブコントロール(PC)
既知またはトランスフェクションによって標的タンパク質の発現を誘導した細胞を使用します。 CRISPR / Cas9 染色の陽性対照として SpyCas9 を発現させた HeLa 細胞(図 2)や、LC3B の陽性対照としてクロロキン処理された HeLa 細胞などが使用できます。 ネガティブコントロール(NC) 既知の siRNA / shRNA 遺伝子を介したサイレンシングを伴う細胞、または標的タンパク質の発現を欠いているか、発現が低下しているノックアウトモデルに由来する細胞を使用して陰性対照とします。 例えば、HIF-1 alpha 染色に対して HIF-1 alpha をノックアウトした MEF 細胞株や、MMP7 染色に対しては MMP7 を発現しない SW480 細胞株などを用いて、ネガティブコントロール実験ができます。 |
図 1:一次抗体抜きのコントロール
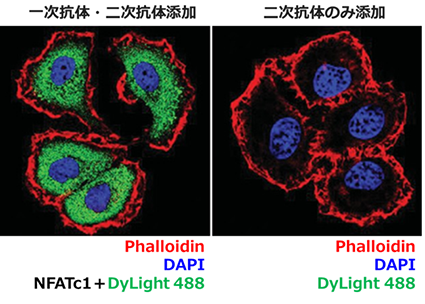
MCF7 細胞内の NFATc1 に結合する一次抗体に対して DyLight 488 標識二次抗体を使用し、ICC / IF を行いました。一次抗体抜きのコントロール(右)においては、一次抗体、二次抗体の双方を加えた場合(左)と異なり、DyLight 488 の緑色蛍光がみとめられません。この実験により、DyLight 488 二次抗体が一次抗体を介して、NFATc1 に特異的に染色できていることが確認できました。
図 2:発現コントロール(ポジティブコントロール)
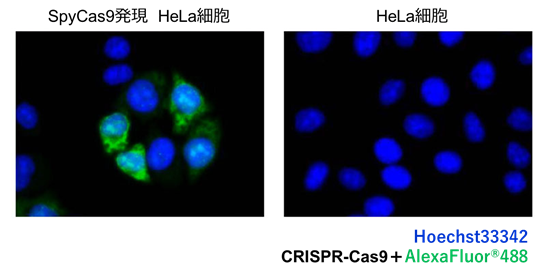
SpyCas9 を発現させた HeLa 細胞と、トランスフェクションを行っていない HeLa 細胞で比較を行っています。SpyCas9 を発現させた HeLa 細胞(左)は、マウス抗 CRISPR / Cas9 一次抗体と AlexaFluor®488 標識二次抗体の双方を反応させることにより、緑色で CRISPR / Cas9 の局在が観察されました。一方、トランスフェクションを行っていない HeLa 細胞(右)では同様の抗体反応を行っても、緑色の蛍光が観察されません。つまり、標的の存在の可否によって、適切な抗体の染め分けが行われたことが分かります。
Alexa Fluor® はモレキュラー プローブス, インコーポレイテッドの登録商標です。
まとめ
4 回のシリーズで免疫染色を成功させるテクニックについて紹介してきましたが、コツはつかめたでしょうか。適切な抗体の選択、サンプルの準備、コントロール実験など、どれが欠けても、非特異的結合により実験へのマイナスの影響が発生してしまいます。
1 つ 1 つのステップを確実に実施することで、高精度な ICC / IF の実現を目指しましょう。
関連コラム
※掲載内容 2021 年 6 月現在の情報に基づいています。

