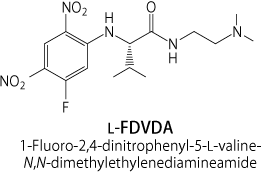
L-FDVDA (1-Fluoro-2,4-dinitrophenyl-5-L-valine-N,N-dimethylethylenediamineamide)
本製品は高感度タグを修飾したアミノ基結合型の光学分割ラベル化剤(キラルラベル化剤)であり[3, 4]、高速液体クロマトグラフィー・質量分析計(LC-MS)で高感度に光学異性体を分離・識別することができます。DL-アミノ酸ラベル化キットでは分離・識別することが難しいサンプル(イソロシンの立体異性体やアミノ酪酸の異性体)のラベル化(誘導体化)にご使用ください。
関連製品 : DL-アミノ酸ラベル化キットの製品情報はこちら
- キラルカラムを使わずに光学異性体を分離
- MS(質量分析計)での高感度検出
- ラベル化したサンプルの安定性が高い 適用サンプル : イソロシン(Ile)の 立体異性体(DL-Ile, DL-allo-Ile)、アミノ酪酸の異性体、ペプチドの配列解析
適用サンプル : イソロシン(Ile)の 立体異性体(DL-Ile, DL-allo-Ile)、アミノ酪酸の異性体、ペプチドの配列解析
製品説明
ラベル化法
| ラベル化剤 | |
|---|---|
 |
・本ラベル化剤 L-FDVDA はアミノ基と反応します。 ※フェノール性水酸基やチオール基にも反応しますが、DL-アミノ酸ラベル化キットの脱ラベル化液(側鎖用)を使用することで、脱離させることができます。 ・ラベル化反応には、DL-アミノ酸ラベル化キットの各種反応試薬を使用することを推奨します(ラベル化剤以外の構成試薬は個別で販売しています)。 ※ラベル化操作と反応機構は、DL-アミノ酸ラベル化キットをご参照ください。 |
HPLC で検出されるラベル化剤由来のピーク
| 名称 | 分子量 | 説明 |
|---|---|---|
| L-FDVDA | 371.36 (C15H22FN5O5) | 未反応のラベル化剤(ラベル化法 2 のみ) |
| L-FDVDA(Hydrolysed) | 369.36 (C15H23N5O6) | ラベル化剤の加水分解物 |
| L-DVDA-S-C6H12OH | 485.52 (C21H35N5O6S) | ラベル化剤と脱ラベル化剤(側鎖用)の反応物(ラベル化法 1 のみ) |
サンプルを分析する前にブランク分析を必ず行ってください。
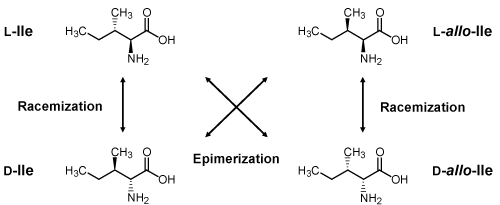
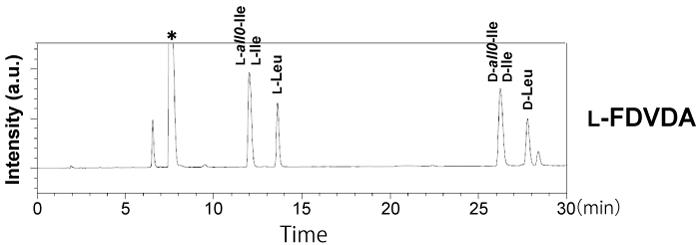
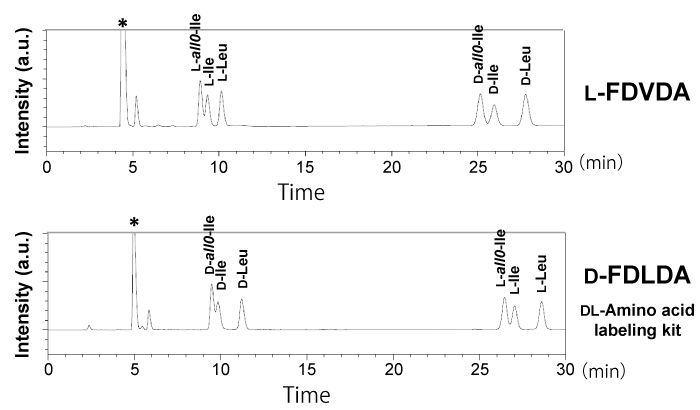
分離困難な Ile の立体異性(DL-Ile と DL-allo-Ile)および DL-Leu の分離(ラベル化法 2)
指定難病であるメープルシロップ尿症のバイオマーカーとして注目されている DL-allo-Ile は既存の光学分割ラベル化剤やキラルカラムでは分離することが非常に難しく、精密に分離・識別することができる分析法は確立されていません。そこで、L-FDVDA でラベル化して分析したところ、C18 カラムでは、DL-Ile と DL-allo-Ile のピークが重なり、分離することができませんでしたが、コスモシール PBr カラムに変更することで DL-Ile と DL-allo-Ile、同一分子量である DL-Leu を分離・識別することができました [1]。L-Ile と L-allo-Ile はベースライン分離することはできませんでしたが、ラベル化剤を D-FDLDA(DL-アミノ酸ラベル化キット)に変更することで、溶出順が逆になり分離が改善しました[1]。 ※ Ile と Leu 以外のアミノ酸も同時に分析する際は、ラベル化法 1 でラベル化を行ってください。
| C18 column |
|---|
 |
| Conditions | |||
|---|---|---|---|
| Column | COSMOSIL 3C18-AR-Ⅱ 3.0 mm I.D. × 150 mm | Flow rate | 0.4 mL/min |
| Mobile phase | A : Acetonitrile / H2O / Formic Acid = 20 / 80 / 0.1 B : Acetonitrile / H2O / Formic Acid = 50 / 50 / 0.1 B conc. 10% → 60%(0 → 30 min)Linear gradient |
Temperature | 40℃ |
| Detection | UV 340 nm | ||
| PBr column |
|---|
 |
| Conditions | |||
|---|---|---|---|
| Column | COSMOSIL 3PBr 3.0 mm I.D. × 150 mm | Flow rate | 0.4 mL/min |
| Mobile phase | A : Methanol / H2O / Formic Acid = 70 / 30 / 0.1 B : Methanol / Formic Acid = 100 / 0.1 B conc. L-FDVDA : 0% → 0% → 30%(0 → 10→ 30 min)Linear gradient D-FDLDA : 5% → 5% → 45%(0 → 10→ 30 min)Linear gradient |
Temperature | 40℃ |
| Detection | UV 340 nm | ||
※本内容の詳細は、使用文献 [1] および「DL-allo-ThrとDL-allo-Ileを含むペプチドの配列解析」をご参照ください。
MS 感度
アキラルカラムによるアミノ酸の光学分離では、Marfey 法による Nα-(5-Fluoro-2,4-dinitrophenyl)-L-alaninamide [L-FDAA]や Nα-(5-Fluoro-2,4-dinitrophenyl)-L-leucinamide [L-FDLA]などのラベル化剤が知られていますが、本ラベル化剤 L-FDVDA は下図の赤丸で囲んだ構造がイオン化しやすいため、UV での感度は既存品と同等ですが、MS での感度は向上します [3, 4]。
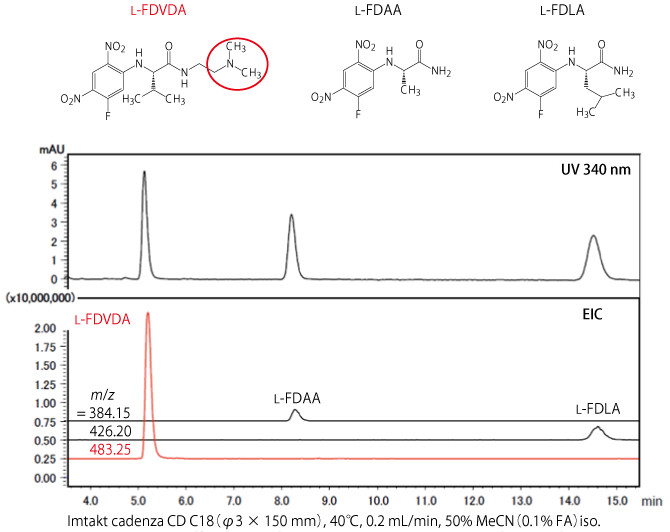
本データは京都大学大学院 薬学研究科 医薬創成情報科学専攻 システムケモセラピー 制御分子学分野 教授 掛谷 秀昭 様 / 特任講師 倉永 健史 様よりご提供いただきました。
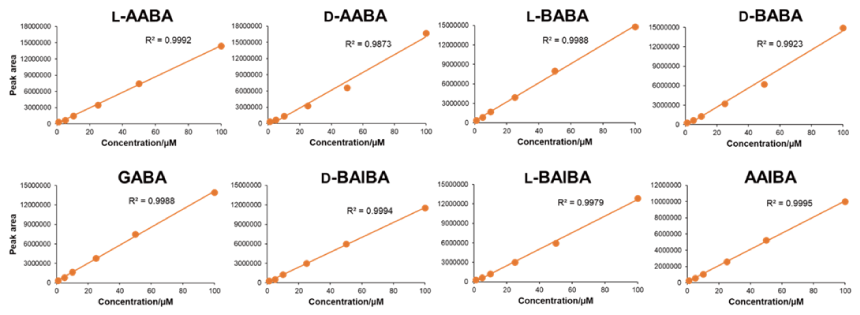
定量性
濃度の異なるアミノ酪酸を本製品によりラベル化し、LC-MS で分析したところ、直線的な検量線が作成できました [2]。
ラベル化サンプルの安定性
ラベル化した各アミノ酪酸を反応日から 1 日後と 7 日後に HPLC 分析を行いました。ラベル化 1 日後と 7 日後でピーク面積値にほとんど変化が無かったため、7 日間経過してもサンプルは安定であることが示されました [2]。
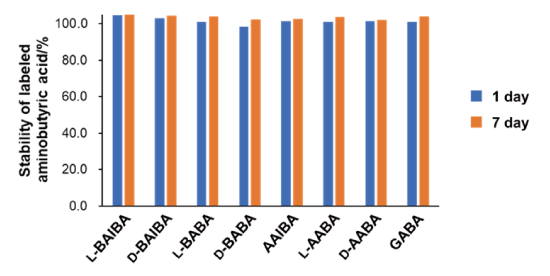
※ 反応終了直後に分析し、得られたピーク面積値を 100% としました。サンプルは冷蔵保存。
製品使用例
LC-MS 分析による DL-アミノ酸の分析(ラベル化法 1 )
L-FDVDA でラベル化した 20 種類の DL-アミノ酸および Gly を一斉分析 したところ、DL-allo-Thr を含む 41 個のアミノ酸の L 体と D 体を汎用的に使用される C18 カラムで分離することができました [1]。 ※ C18 カラムでは DL-Ile と DL-allo-Ile を分離することはできません。
| Analytical conditions | ||
|---|---|---|
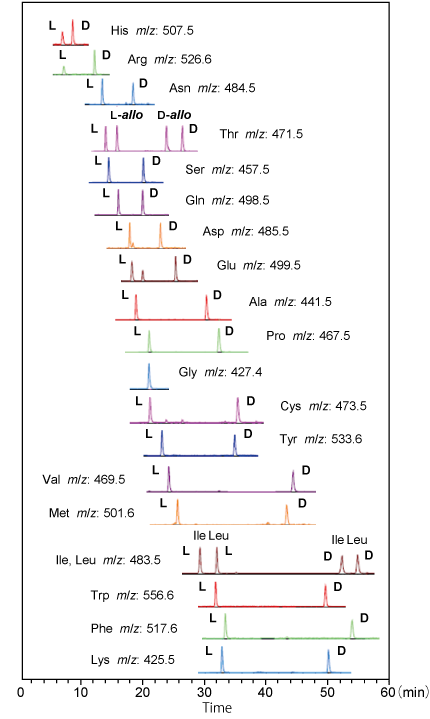 |
LC conditions | |
| Column | COSMOSIL 3C18-AR-Ⅱ 3.0 mm I.D. × 150 mm | |
| Mobile phase | A : Acetonitrile / H2O / Formic Acid = 10 / 90 / 0.1 B : Acetonitrile / H2O / Formic Acid = 50 / 50 / 0.1 B conc. 10% → 70%(0 → 60 min)Linear gradient |
|
| Flow rate | 0.4 mL/min | |
| Temperature | 40℃ | |
| MS conditions | ||
| Ionization | ESI/APCI (DUIS)(positive mode) | |
| Mode | SIM | |
| Nebrizing gas flow | 2.0 L/min | |
| Drying gas flow | 5.0 L/min | |
| Heating gas flow | 7.0 L/min | |
| DL temperature | 200℃ | |
| Desolvation temperature | 450℃ | |
| Interface voltage | 3.0 kV | |
アミノ酪酸の異性体の一斉分離(ラベル化法 2)
既存の光学分割ラベル化剤やキラルカラムでは分離することが難しい 8 種類のアミノ酪酸の異性体を L-FDVDA でラベル化し、コスモシール 3C18-EB カラムを用いて分析したところ、全てのアミノ酪酸を分離 ・識別することができました(DL-BAIBA はベースライン分離できていません)[2]。また、同一分子量である N-メチル-DL-アラニンのピークとも分離することができました。
※本内容の詳細は、使用文献 [2] および「全アミノ酪酸の構造異性体と鏡像異性体の一斉分析」をご参照ください。
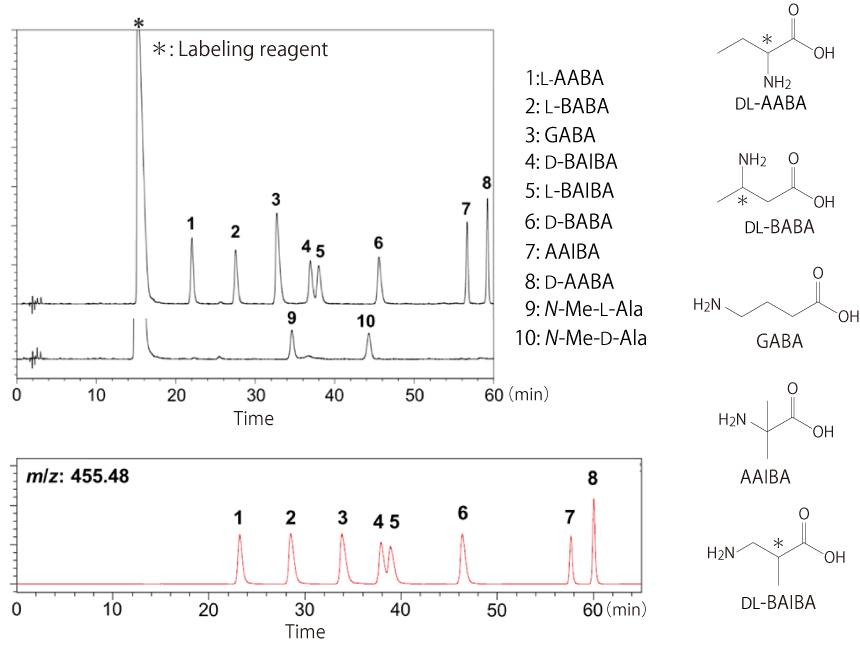
| LC conditions | MS conditions | ||
|---|---|---|---|
| Column | COSMOSIL 3C18-EB 2.0 mm I.D. × 150 mm | Ionization | ESI/APCI (DUIS)(positive mode) |
| Mobile phase | A : Methanol / H2O / Formic Acid = 30 / 70 / 0.1 B : Methanol / H2O / Formic Acid = 60 / 40 / 0.1 B conc. 10% → 35% →100%(0 → 40 → 60 min)Linear gradient |
Mode | SIM |
| Nebrizing gas flow | 2.0 L/min | ||
| Drying gas flow | 5.0 L/min | ||
| Flow rate | 0.2 mL/min | Heating gas flow | 7.0 L/min |
| Temperature | 40℃ | DL temperature | 200℃ |
| Detection | UV 340 nm | Desolvation temperature | 450℃ |
| Interface voltage | 3.0 kV | ||
使用文献
参考文献
https://doi.org/10.1021/acschembio.0c00517
https://doi.org/10.1016/bs.mie.2021.11.004
関連資料
価格表
| 製品名 | 規格 | 貯法 | 製品番号 | 容 量 | オンライン カタログへ |
|---|---|---|---|---|---|
| 1-Fluoro-2,4-dinitrophenyl-5-L-valine-N,N-dimethylethylenediamineamide | SP | 冷蔵 | 20363-24 | 50 mg |
本製品は京都大学が特許出願し、ナカライテスク株式会社が許諾を得て製造販売しています。
COSMOSIL / コスモシールはナカライテスク株式会社の登録商標です。
関連製品
※研究者の皆さまのご所属などは、データご提供時の情報に基づいています。
※掲載内容は予告なく変更になる場合があります。