クロマトグラフィー
DL-アミノ酸ラベル化キットを用いたアミロイド β 中のラセミ化・異性化の同定
本ページを PDF でご覧になりたい方はこちら<TN-26-2>
はじめに
DL-アミノ酸ラベル化キットを用いて、ペプチドをラベル化(誘導体化)することで、塩酸を用いた加水分解処理を行わず、アルツハイマー病の原因物質であるアミロイド β 中のラセミ化・異性化しているアミノ酸を高速液体クロマトグラフィー(HPLC)と高速液体クロマトグラフィー・質量分析計(LC-MS)により非常に簡単な条件で分離・識別することができましたので、紹介します。本研究成果は Anal Bioanal Chem. 2022;414(14):4039-4046. と Analyst. 2023 Mar 13;148(6):1209-1213. に掲載されています。本研究は京都大学大学院・薬学研究科・創発医薬科学専攻・システムケモセラピー・制御分子学分野と共同で遂行されました。
アミロイド β 中のアミノ酸のラセミ化・異性化の分析
アルツハイマー病は、脳に蓄積された老人斑によって引き起こされます。老人斑の主成分は、アミロイド β(Aβ)と呼ばれる全長 42 残基のペプチドの凝集体です。Aβ の 1、7、23 残基目に位置するアスパラギン酸(Asp)のラセミ化や異性化が Aβ の凝集を促進し、細胞毒性が向上することが複数の研究により報告されています。通常、ペプチド中に含有しているアミノ酸の同定は、塩酸を用いてペプチドを加水分解した後、誘導体化試薬でラベル化(誘導体化)処理を行い、HPLC により分析します(図 1)。しかしながら、加水分解の際に L 体から D 体のアミノ酸へのラセミ化やアミノ酸自体の分解、ペプチドの配列によっては加水分解が難しいといった問題点があります。また、異性化したアミノ酸は加水分解によりペプチドが分解されるため、主鎖と側鎖のどちらからペプチド鎖が伸長していたかを識別することができません。そのため、Aβ 中の Asp 残基の DL 体と DL-iso 体を加水分解せずに同定できる分析法の開発が必要となっています。
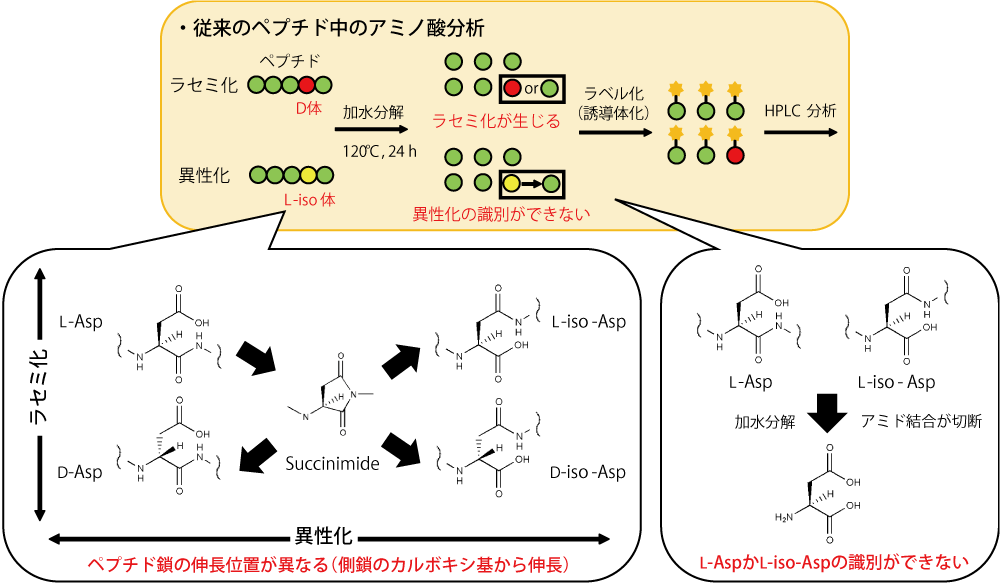
図 1. 従来のペプチド中のアミノ酸分析の問題点
そこで、アミノ酸の DL 体を識別することができる DL-アミノ酸ラベル化キット(#19942-74)を用いて、酵素消化した際に生成する Aβ 断片をモデルペプチドとして、1、7、23 残基目の Asp がラセミ化・異性化した計 12 種類のペプチドをラベル化した後、HPLC および LC-MS により分離・識別することを試みました。
複数のアミノ酸がラセミ化したペプチドの分離・識別
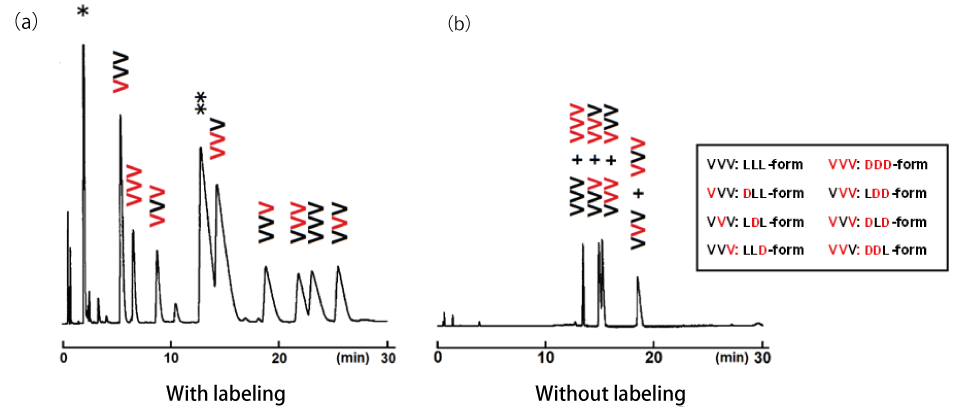
Aβ の分析を実施する前に、DL-アミノ酸ラベル化キットでラベル化したペプチドの分離能を確認するために、キラルカラムでも分離することが難しいペプチド中のアミノ酸の DL 体の分離・識別を試みました。モデルペプチドとして、すべてのアミノ酸がバリン(Val)からなる 8 つのトリペプチド(H-VVV-NH2)を合成し、DL-アミノ酸ラベル化キットを用いてラベル化し、ラベル化未処理のものと分離パターンを比較しました。
| Conditions(a) | |
|---|---|
| Column | COSMOCORE 2.6Cholester 2.1 mm I.D. × 100 mm |
| Mobile phase | A : 0.1% Formic Acid - Acetonitrile / H2O = 20 / 80 B : 0.1% Formic Acid - Acetonitrile / H2O = 50 / 50 B conc. 5 → 15%( 0 → 30 min)Linear gradient |
| Flow rate | 0.4 mL/min |
| Temperature | 40℃ |
| Detection | UV 340 nm |
*Labeling reagent(Hydrolysed)
**D-DLDA-S-C6H12OH
| Conditions(b) | |
|---|---|
| Column | COSMOCORE 2.6C18 2.1 mm I.D. × 100 mm |
| Mobile phase | A : 0.1% TFA-H2O B : 0.08% TFA-Acetonitrile B conc. 0 → 30%( 0 → 30 min)Linear gradient |
| Flow rate | 0.4 mL/min |
| Temperature | 40℃ |
| Detection | UV 220 nm |
図 2. (a)DL-アミノ酸ラベル化キットでラベル化したクロマトログラム、(b)ラベル化未処理のクロマトグラム
DL-アミノ酸ラベル化キットでラベル化したサンプルでは 8 種類全てのペプチドを分離・識別することができました(図 2-a)。一方、ラベル化処理していないサンプルではジアステレオマーの関係にあるペプチドは完全にピークが重なり分離・識別することはできませんでした(図 2-b)。以上の結果より、DL-アミノ酸ラベル化キットでラベル化することで、分離能が向上し、ペプチド中のアミノ酸のラセミ化の有無を精密に測定可能であることが示されました1)。
酵素消化により生成する Aβ 部分配列
Aβ1-42 をトリプシンとエンドペプチダーゼである Glu-C を用いて、酵素消化した際に得られる部分配列を図 3 に示しています。酵素消化により得られる Asp 残基を含んだ 12 種類の部分配列(Fragment A、B、C)をモデルに DL-アミノ酸ラベル化キットを用いて、ラベル化した後、LC-MS 分析により、各部分配列の同定を行いました。
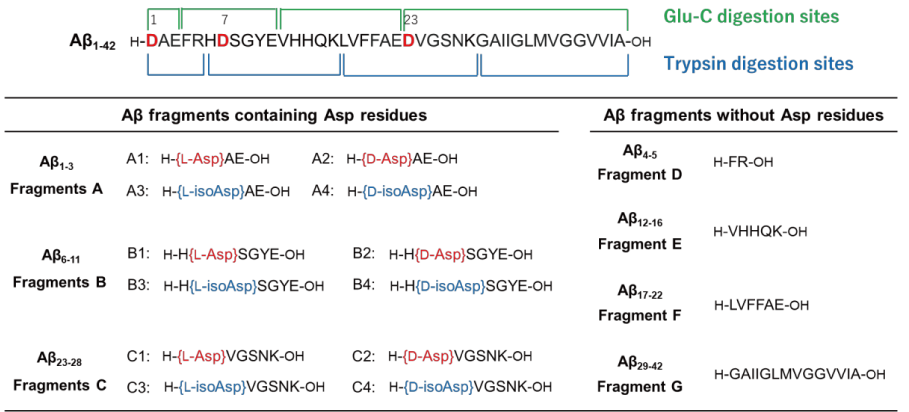
図 3. トリプシンと Glu-C を用いた酵素消化により生成する Aβ 部分配列
DL-アミノ酸ラベル化キットを用いてラベル化したラセミ化・異性化した Aβ 部分配列の分離・同定
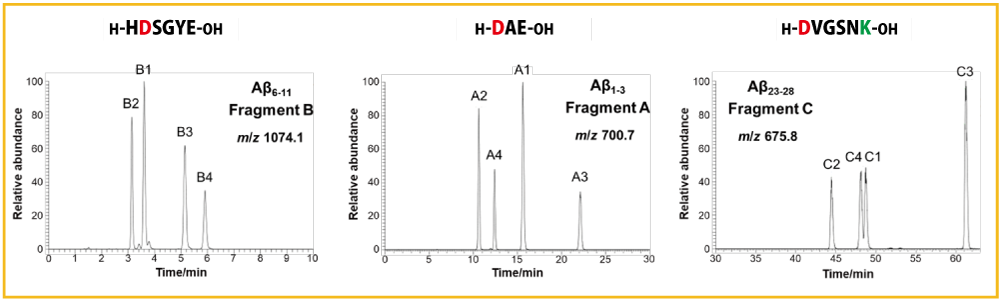
ラセミ化・異性化した Asp 残基を含む 3 種類の Aβ 部分配列(計 12 種類)をラベル化した後、LC-MS により分析しました。
| Conditions | |||
|---|---|---|---|
| Column | COSMOSIL 3C18-AR-Ⅱ 3.0 mm I.D. × 150 mm | Flow rate | 0.4 mL/min |
| Mobile phase | A : 0.1% Formic Acid - Acetonitrile / H2O = 20 / 80 B : 0.1% Formic Acid - Acetonitrile / H2O = 50 / 50 B conc. 0 → 35% (0 → 60 min)Linear gradient |
Temperature | 40℃ |
| Detection | ESI(+)-MS | ||
図 4. ラベル化した Aβ 部分配列の HPLC クロマトグラム
他の研究では Aβ 部分配列ごとにグラジエント条件や使用しているカラムが異なっていることが多く、分析時間が長いうえ、分離条件が煩雑であることから、再現性を得ることが難しいと考えられます。一方、本研究では、汎用的な C18 カラムを用いて、非常に簡単なグラジエント条件でラセミ化・異性化した 12 種類のペプチドを一斉分離することができました(図 4)。
各 Aβ 部分配列のラベル化剤との反応性
本研究で使用している DL-アミノ酸ラベル化キットのラベル化剤 D-FDLDA はアミノ基と一部アミノ酸の側鎖に結合します(DL-アミノ酸ラベル化キット 参照)。また、われわれの先行研究において、アミノ酸と同様に短鎖ペプチドの N 末端にもラベル化剤が結合し、ペプチド中の DL 体の識別が可能であることが明らかとなっています1)。本研究において、Aβ1-3 と Aβ6-11、N 末端のアミノ基と C 末端に位置しているリシン(Lys)側鎖のアミノ基の 2 カ所にラベル化剤が結合する Aβ23-28 に対するラベル化剤の反応性の経時変化を確認しました。500 µM の各 Aβ 部分配列をラベル化方法 1 でラベル化したところ、反応性の違いは確認されましたが、50ºC で一晩静置反応させることで、ラベル化剤とペプチドが完全に結合することが示されました(図 5)2)。また、ラベル化した各 Aβ 部分配列の光学純度は > 99.9% であり、ラベル化反応中にラセミ化や異性化は生じないことが明らかとなりました2)。
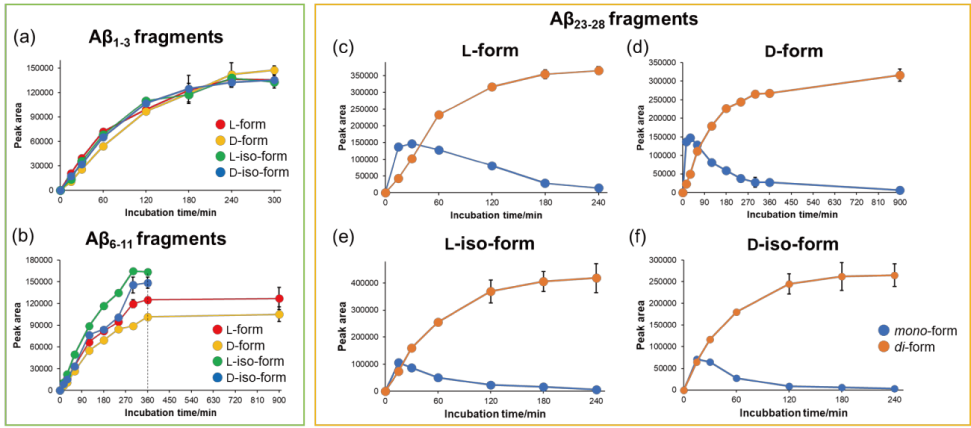
図 5. ラセミ化・異性化した(a) Aβ1-3、(b) Aβ6-11 と(c)~(f)Aβ23-28 とラベル化剤 D-FDLDA の反応性の経時変化
※ Aβ23-28 は N 末端のアミノ基だけでなく、Lys 側鎖のアミノ基にもラベル化剤が結合します。
ラベル化したサンプルの安定性
Aβ は凝集性があるため、定量的に測定するためには各 Aβ 部分配列の安定性を評価する必要があります。そこで、本研究で使用した Aβ 部分配列と他の研究で使用されているトリプシン消化により生成する Aβ 部分配列の凝集性の有無をチオフラビン T(ThT)蛍光測定により確認しました。1 mM になるように各 Aβ 部分配列のストック溶液を調製したところ、トリプシン消化により生成する Aβ17-28 のみ白濁が生じました(図 6-a)。終濃度 200 µM(in 1×PBS)になるようにサンプルを調製し、37℃ で 24 時間インキュベートさせた後、ThT 蛍光測定で凝集の有無を確認したところ、本研究で使用した Aβ 部分配列はネガティブコントロールと同等の蛍光強度であり、凝集は生じていないことが示されました(図 6-b)。一方、他の研究で使用されている Aβ17-28 は ThT の蛍光強度の値が著しく高く、凝集が生じていることが示唆されました(図 6-b)。さらに、ラベル化した各ペプチドの安定性を評価するために、ラベル化した直後のサンプルを HPLC 分析し、得られたピーク面積の値を基準に、1 日後と 7 日後のピーク面積の値からサンプルの安定性を評価しました。その結果、1 日後と 7 日後ともにピーク面積値はほとんど減少していないことが確認されました(図 6-c)。以上の結果から、ラベル化したサンプルは冷蔵(4℃)で長期間保管可能であり、定量的に測定可能であることが示されました。
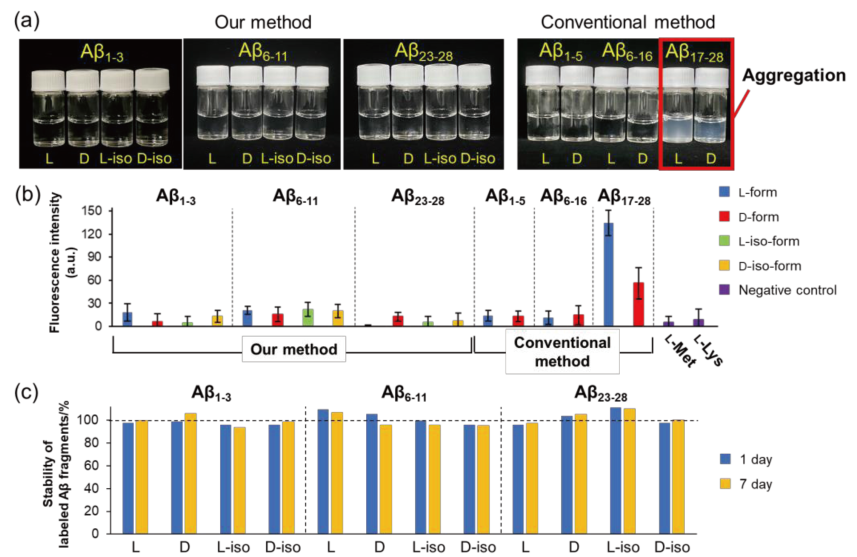
図 6.
(a)本研究と先行研究で使用された Aβ 部分配列の溶液(1 mM)の写真
(b)ThT 蛍光測定による Aβ 部分配列の凝集性の確認
(c)ラベル化した Aβ 部分配列の 1 日後と 7 日後のピーク面積の変化
参考文献
- 1)Ozaki M, Kuwayama T, Hirose T, Shimotsuma M, Hashimoto A, Kuranaga T, Kakeya H. Anal Bioanal Chem. 2022;414:4039-4046.
DOI : https://doi.org/10.1007/s00216-022-04048-w - 2)Ozaki M, Shimotsuma M, Kuranaga T, Kakeya H, Hirose T. Analyst. 2023;148:1209-1213.
DOI : https://doi.org/10.1039/D2AN01885C
※ Selected as Analyst HOT Articles 2023 and Featured on Front Cover
価格表
分析に用いた製品
※本測定法は大規模な商業利用をする場合、ライセンス料が必要となります。
COSMOSIL / コスモシール、COSMOCORE / コスモコアはナカライテスク株式会社の登録商標です。
関連製品
※研究者の皆さまのご所属などは、データご提供時の情報に基づいています。
※掲載内容は予告なく変更になる場合があります。

