
COSMOSIL Cholester
コスモシール Cholester はコレステリル基をシリカゲルに化学結合した逆相クロマトグラフィーカラムです。C18 型カラムと疎水性がほぼ同じであるため C18 型カラムの分析条件をそのまま使用することができます。一方、C18 型カラムより優れた分子形状認識能により、C18 型カラムでは分離できなかった構造類似化合物の分離に威力を発揮します。また、価格が C18 型カラムと同等ですので、C18 型カラムで分離が達成されない場合のセカンドチョイスカラムとして気軽にお試しいただけます。
- コレステリル基結合型
- 優れた分子形状認識能
- C18 カラムと同じ移動相で分析可能
適合するサンプル例
- 天然物
- 構造類似化合物
- ポリフェノール、カテキン、脂溶性ビタミン、フラボンなど
製品説明
物性
| 充填剤名称 | Cholester | ||
|---|---|---|---|
| シリカゲル | 全多孔性球状高純度シリカゲル | Core-Shell 型シリカゲル | |
| 平均粒子径(µm) | 2.5 | 3, 5 | 2.6 |
| 平均細孔径(nm) | 13 | 12 | 9 |
| 比表面積(m2/g) | 330 | 300 | 150 |
| 固定相構造 |  |
||
| 化学結合基 | コレステリル基 | ||
| USP カテゴリー | L101 | ||
| 結合形式 | モノメリック | ||
| 主な相互作用 | 疎水性 分子形状認識能 |
||
| エンドキャッピング | あり | ||
| 炭素含有率 | 21 | 20 | ー |
| 使用可能 pH 範囲 | 2 〜 7.5 | ||
疎水性相互作用
コスモシール Cholester は平均的な C18 カラムと同等の疎水性を有します。これは C18 から Cholester へ移行する際に移動相の条件検討が必要なく、カラムを C18 から Cholester に変えるだけですぐに結果が得られることを示しています。
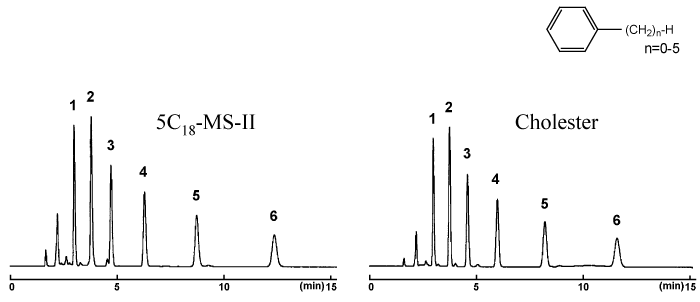
| Conditions | |||
|---|---|---|---|
| Column size | 4.6 mm I.D. × 150 mm | Sample |
|
| Mobilephase | Methanol / H2O = 80 / 20 | ||
| Flow rate | 1.0 mL/min | ||
| Temperature | 30℃ | ||
| Detection | UV 254 nm | ||
分子形状認識能と分離の改善
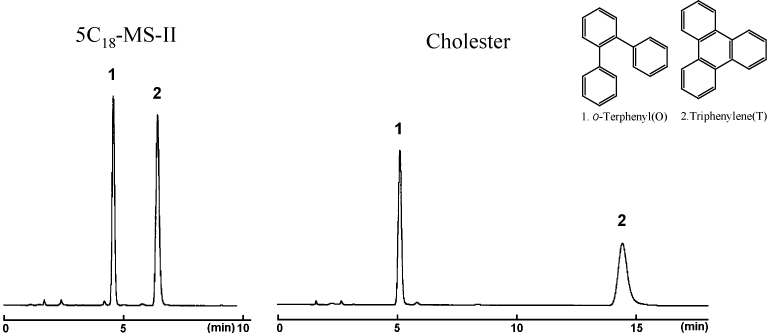
分子形状認識能
コスモシール Cholester は剛直(Rigid)な固定相構造の効果によって、立体的な o-Terphenyl よりも平面的な Triphenylene を非常に強く保持します。 Cholester は C18 や C30 よりもサンプルの形状に対する認識能が高いことを示しています。
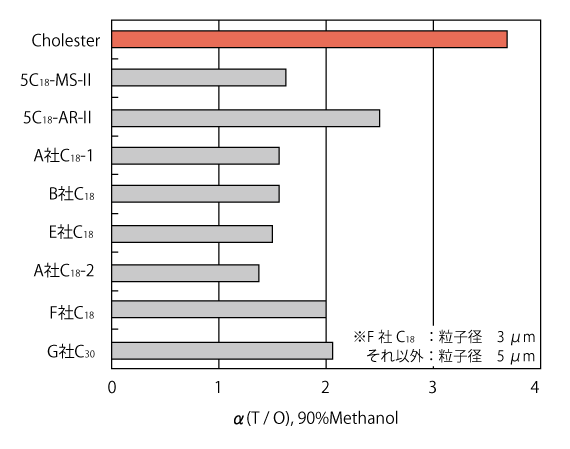
図 : 分子形状認識能の比較
| Conditions | |||
|---|---|---|---|
| Column size | 4.6 mm I.D. × 150 mm | Detection | UV 254 nm |
| Mobilephase | Methanol / H2O = 90 / 10 | Sample |
|
| Flow rate | 1.0 mL/min | ||
| Temperature | 30℃ | ||
分離の改善
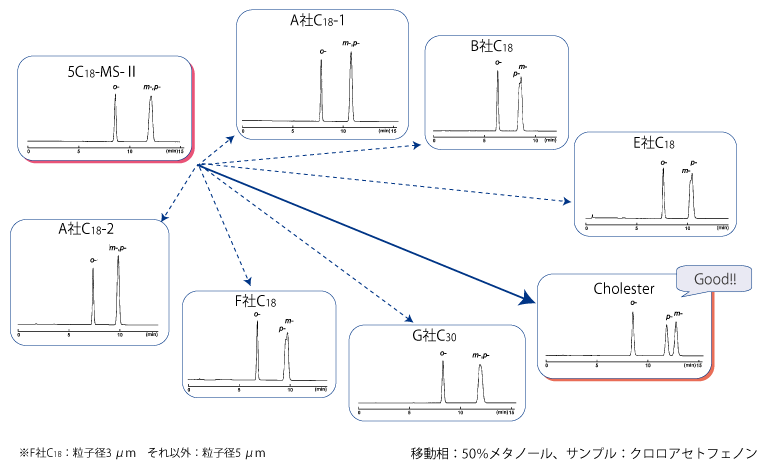
C18 カラムは多くのメーカーより販売されています。各メーカーの C18 カラムは細かい性能に違いはありますが、基本的には同様の性能を示します。そのため、C18 カラムで分離が難しいサンプルを他メーカーの C18 カラムで分析しても分離が改善する可能性はそれほど高くありません。コスモシール Cholester は C18 カラムよりも高い分子形状認識能を持つため、分離を改善できる可能性があります。 下図では各種 C18 や C30 カラムで分離が困難なクロロアセトフェノンの位置異性体を Cholester で分離した例を示しています。
他社 C18・C30 カラムとの比較
分取効率の向上
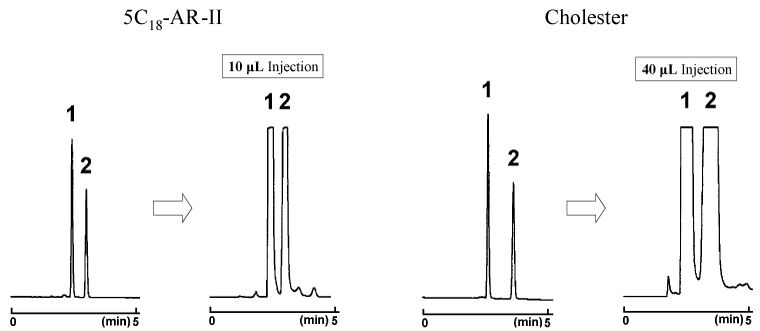
下図の分析例では、わずかな分離能の違いがあるものの 2 種類のカラムとも良好な分離を示しています。 しかし、分取精製を行う場合には、そのわずかな分離能の差によりサンプル負荷量が大きく変化します。下図の例ではコスモシール Cholester は、C18 カラムよりもサンプル負荷量が 4 倍になりました。
分取効率の比較
| Conditions | |||
|---|---|---|---|
| Column size | 4.6 mm I.D. × 150 mm | Sample |
 |
| Mobilephase | Methanol | ||
| Flow rate | 1.0 mL/min | ||
| Temperature | 30℃ | ||
| Detection | UV 254 nm | ||
バリデーション
コスモシール Cholester は、4.6 mm I.D. × 150 mm、4.6 mm I.D. × 250 mm の 2 サイズについてバリデーションをサポートしています。
カラム 1 本毎に 2 種類の証明書を添付しています。項目の詳細はこちらを参照ください。
製品使用例
分析例
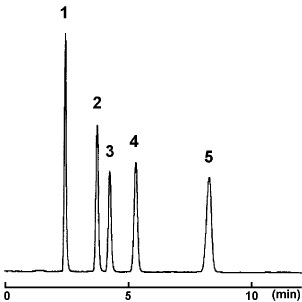
カテキン(市販緑茶飲料)
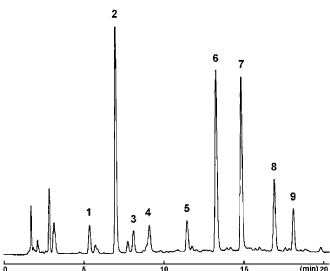
| Conditions | |||
|---|---|---|---|
| Column | COSMOSIL Cholester 4.6 mm I.D. × 150 mm | Sample | Green Tea
|
| Mobilephase |
A : Acetonitrile / 20 mmol/L Phosphate Buffer(pH 2.5) = 10 / 90 |
||
| Flow rate | 1.0 mL/min | ||
| Temperature | 30℃ | ||
| Detection | UV 280 nm | Inj. Vol. | 1.0 µL |
カロテン
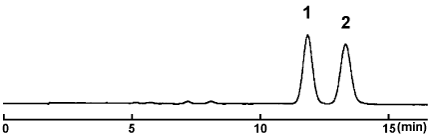
| Conditions | |||
|---|---|---|---|
| Column | COSMOSIL Cholester 4.6 mm I.D. × 150 mm | Sample
|
 |
| Mobilephase |
Tetrahydrofuran / Methanol = 20 / 80 |
||
| Flow rate | 1.0 mL/min | ||
| Temperature | 30℃ | ||
| Detection | UV 470 nm | ||
フラボン
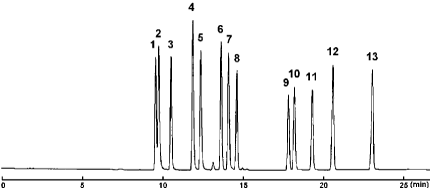
| Conditions | |||
|---|---|---|---|
| Column | COSMOSIL Cholester 4.6 mm I.D. × 150 mm | Sample |
|
| Mobilephase | A : Acetonitrile / 20mmol/L Phosphate Buffer(pH 2.5) = 20 / 80 B : Acetonitrile / 20 mmol/L Phosphate Buffer(pH 2.5) = 70 / 30 B conc. 0 → 100% 20 min Linear Gradient |
||
| Flow rate | 1.0 mL/min | ||
| Temperature | 30℃ | ||
| Detection | UV 280 nm | ||
サイコサポニン
| Conditions | |||
|---|---|---|---|
| Column | COSMOSIL Cholester 4.6 mm I.D. × 150 mm | Sample |
|
| Mobilephase | Acetonitrile / H2O = 45 / 55 | ||
| Flow rate | 1.0 mL/min | ||
| Tempera ture | 30℃ | ||
| Detection | ELSD, Gain=6 | ||
使用文献
- Oku N, Matoba S, Momose Yamazaki Y, Shimasaki R, Miyanaga S, Igarashi Y. Complete Stereochemistry and Preliminary Structure-Activity Relationship of Rakicidin A, a Hypoxia-Selective Cytotoxin from Micromonospora sp. J. Nat. Prod. 2014;77(11):2561-2565.
- Iwasaki A, Sumimoto S, Ohno O, Suda S, Suenaga K. Kurahamide, a Cyclic Depsipeptide Analog of Dolastatin 13 from a Marine Cyanobacterial Assemblage of Lyngbya sp. Bulletin of the Chemical Society of Japan. 2014;87(5):609-613.
- Kobayashi T, Ogino A, Miyake Y, Mori H, Hosoda A, Fujita M, Tsuno T, Adachi S. Lipase-Catalyzed Esterification of Triterpene Alcohols and Phytosterols with Oleic Acid. Journal of the American Oil Chemists' Society. 2014;91(11):1885-1890.
- Yahagi T, Yakura N, Matsuzaki K, Kitanaka S. Inhibitory effect of chemical constituents from Artemisia scoparia Waldst. et Kit. on triglyceride accumulation in 3T3-L1 cells and nitric oxide production in RAW 264.7 cells. Journal of Natural Medicines. 2014;68(2):414-420.
- Jian Z, Ray T, Wu A, Jones L, Forseth R. Proton exchange reactions in isotope chemistry (II) synthesis of stable isotope-labeled LCQ908. Journal of Labelled Compounds and Radiopharmaceuticals. 2014;57(12):670-673.
- Soukup J, Bocian S, Jandera P, Buszewski B. Comparison of four cholesterol-based stationary phases for the separation of steroid hormones. Journal of Separation Science. 2014;37(4):345-351.
- Janicka M, Pachuta-Stec A. Retention-property relationships of 1,2,4-triazoles by micellar and reversed-phase liquid chromatography. Journal of Separation Science. 2014;37(12):1419-1428.
- De Vrieze M, Verzele D, Szucs R, Sandra P, Lynen F. Evaluation of sphingomyelin, cholester, and phosphatidylcholine-based immobilized artificial membrane liquid chromatography to predict drug penetration across the blood-brain barrier. Analytical and Bioanalytical Chemistry. 2014;406(25):6179-6188.
- Takahashi K, Oda Y, Toyoda Y, Fukami T, Yokoi T, Nakajima M. Regulation of Cytochrome b5 Expression by miR-223 in Human Liver: Effects on Cytochrome P450 Activities. Pharmaceutical Research. 2014;31(3):780-794.
- Isobe T, Okuhata H, Miyasaka H, Jeon BS, Park HD. Detoxification of microcystin-LR in water by Portulaca oleracea cv. Journal of Bioscience and Bioengineering. 2014;117(3):330-332.
- Homayouni Moghadam F, Dehghan M, Zarepur E, Dehlavi R, Ghaseminia F, Ehsani S, Mohammadzadeh G, Barzegar K. Oleo gum resin of Ferula assa-foetida L. ameliorates peripheral neuropathy in mice. Journal of Ethnopharmacology. 2014;154(1):183-189.
- Kawamura K, Yamasaki T, Kumata K, Furutsuka K, Takei M, Wakizaka H, Fujinaga M, Kariya K, Yui J, Hatori A, Xie L, Shimoda Y, Hashimoto H, Hayashi K, Zhang MR. Binding potential of (E)-[11C]ABP688 to metabotropic glutamate receptor subtype 5 is decreased by the inclusion of its 11C-labelled Z-isomer. Nuclear Medicine and Biology. 2014;41(1):17-23.
- Fukumoto Y, Shimizu H, Tashiro A, Chatani N. Synthesis of α-Silylmethyl-α,β-Unsaturated Imines by the Rhodium-Catalyzed Silylimination of Primary-Alkyl-Substituted Terminal Alkynes. J. Org. Chem. 2014;79(17):8221-8227.
- Katsuta S, Saeki H, Tanaka K, Murai Y, Kuzuhara D, Misaki M, Aratani N, Masuo S, Ueda Y, Yamada H. Synthesis and optical reactivity of 6,13-α-diketoprecursors of 2,3,9,10-tetraalkylpentacenes in solution, films and crystals. J. Mater. Chem. C. 2014;2:986-993.
- Iwasaki A, Ohno O, Sumimoto S, Suda S, Suenaga K. Kurahyne, an acetylene-containing lipopeptide from a marine cyanobacterial assemblage of Lyngbya sp. RSC Adv. 2014;4:12840-12843.
- Maneesan J, Matsuura H, Tagami T, Mora H, Kimura A. Production of 1,5-anhydro-d-fructose by an α-glucosidase belonging to glycoside hydrolase family 31. Bioscience, Biotechnology, and Biochemistry. 2014;78(12):2064-6068.
- Ratnoglik SL, Aoki C, Sudarmono P, Komoto M, Deng L, Shoji I, Fuchino H, Kawahara N, Hotta H. Antiviral activity of extracts from Morinda citrifolia leaves and chlorophyll catabolites, pheophorbide a and pyropheophorbide a, against hepatitis C virus. Microbiology and Immunology. 2014;58(3):188-194.
- Bai T, Zhang D, Lin S, Long Q, Wang Y, Ou H, Kang Q, Deng Z, Liu W, Tao M. Operon for Biosynthesis of Lipstatin, the Beta-Lactone Inhibitor of Human Pancreatic Lipase. Appl. Environ. Microbiol. 2014;80(24):7473-7483.
- Iwai T, Kubota T, Fromont J, Kobayashi J. Nagelamide I and 2,2′-Didebromonagelamide B, New Dimeric Bromopyrrole-Imidazole Alkaloids from a Marine Sponge Agelas sp. Chem. Pharm. Bull. 2014;62(2):213-216.
- Cui X, Inagaki Y, Wang D, Gao J, Qi F, Gao B, Kokudo N, Fang D, Tang W. The supercritical CO2 extract from the skin of Bufo bufo gargarizans Cantor blocks hepatitis B virus antigen secretion in HepG2.2.15 cells. BioScience Trends. 2014;8(1):38-44.
関連資料
取扱説明書 :
COSMOSIL Technical Note :
関連動画
COSMOSIL Cholester ~ C18 カラムで分離不十分な場合の対処法~
価格表
分析・分取カラム(粒子径 5 µm)
COSMOSIL Cholester
*1 ガードカートリッジカラム(2 個入り)。使用には、内径 4.6 mm 用 ダイレクトカートリッジホルダー(別売#19989-71)が必要です。
*2 バリデーション対象カラム
分析カラム(粒子径 3 µm)
COSMOSIL 3Cholester
ガードカートリッジカラム(2 個入り)。使用には、*1 内径 2.0 mm 用 ガードカートリッジホルダー(別売 #11884-71)、*2 内径 4.6 mm 用ダイレクトカートリッジホルダー(別売#19989-71)が必要です。
※価格表に記載のないカラムサイズをご要望の際はお問い合わせください。
COSMOSIL / コスモシールはナカライテスク株式会社の登録商標です。 COSMOCORE / コスモコアはナカライテスク株式会社の登録商標です。
関連製品
※掲載内容は予告なく変更になる場合があります。


