クロマトグラフィー
短鎖・中鎖・長鎖核酸の逆相 HPLC 分析
本ページを PDF でご覧になりたい方はこちら<TN-32>
はじめに
核酸の分析においては、短鎖(オリゴヌクレオチド)もしくは長鎖のどちらかに焦点を当てて分析条件を検討している研究が多く、短鎖から長鎖までの幅広い核酸の分析条件を網羅的に論じた報告例はありませんでした。この度、数十 nt の短鎖から、数百 ~ 数千 nt の中・長鎖にわたる幅広い鎖長の分析条件について検討しましたので、紹介します。なお、本研究成果は、Analytical Methods に掲載され、Front Cover にも選ばれています1)。
本テクニカルノート全体の実験概要
核酸は、10 nt で約 3.4 nm という巨大な分子であるため、通常の細孔径(ノーマルポア、8 ~ 13 nm 程度)を持つ充填剤では、鎖長の大きな核酸は細孔内部に入りづらく、良好な分離が得られません。この課題を解決するために、弊社では細孔径 > 30 nm のスーパーワイドポアを有する充填剤を充填したコスモシール RNA-RP1 カラムを開発しました。本カラムでは、長鎖の核酸も細孔に入ることができるため、COVID-19 ワクチンにも使用されているような数千 nt の長鎖 ssRNA も分析できることが弊社の先行研究で示されています2)。本カラムとノーマルポアおよびワイドポア(30 nm 程度)カラムを用いて、さまざまな鎖長の核酸を分析し、分離パターンを比較しました。また、最適化した分析条件をもとに、in vitro 転写によって合成した数百 nt の中鎖および数千 nt の長鎖核酸中の不純物分離ならびに分取精製を行いました。
核酸の鎖長とそれに適した充填剤および移動相
ポリアデニル鎖(アデニン数 10 個 ~ 50 個)および ssRNA Ladder にて一本鎖核酸の分析を行った結果、短鎖核酸(オリゴヌクレオチド)は移動相 A : HFIP + TEA、 移動相 B : MeOH、充填剤 : ノーマルポア or ワイドポア C18 充填剤で、また、中鎖・長鎖核酸は移動相 A : TEAA + PB、移動相 B : MeCN or MeCN/MeOH(1/1, v/v)、充填剤 : スーパーワイドポア C18 充填剤で、分析すると好ましい結果が得られています。
| 核酸の 種類 | 核酸の 鎖長 | 充填剤の 最適な細孔径 | 充填剤の 模式図 | 弊社対応 カラム | 最適な 移動相 |
|---|---|---|---|---|---|
| 短鎖 | ~ 100 nt (~ 約 30 nm) |
ノーマルポア (8 ~ 13 nm 程度) |
 (コアシェル型) |
COSMOCORE 2.6C18 | HFIP + TEA / MeOH |
 (フルポーラス型) |
COSMOSIL 3C18-MS-II | ||||
| 中鎖 |
100 ~ 500 nt (約 30 ~ 170 nm) |
スーパーワイドポア (> 30 nm) |
 |
COSMOSIL RNA-RP1 | TEAA + PB / MeCN |
|
500 ~ 1,000 nt (約 170 ~ 350 nm) |
TEAA + PB / MeCN + MeOH |
||||
| 長鎖 |
1,000 ~ 7,000 nt (約 350 ~ 2,500 nm) |
HFIP : 1,1,1,3,3,3-ヘキサフルオロ-2-プロパノール、TEA : トリエチルアミン、TEAA : トリエチルアミン酢酸、PB : リン酸緩衝液、MeCN : アセトニトリル、MeOH : メタノール
中鎖・長鎖核酸とそれに適応する充填剤の模式図およびクロマトグラム
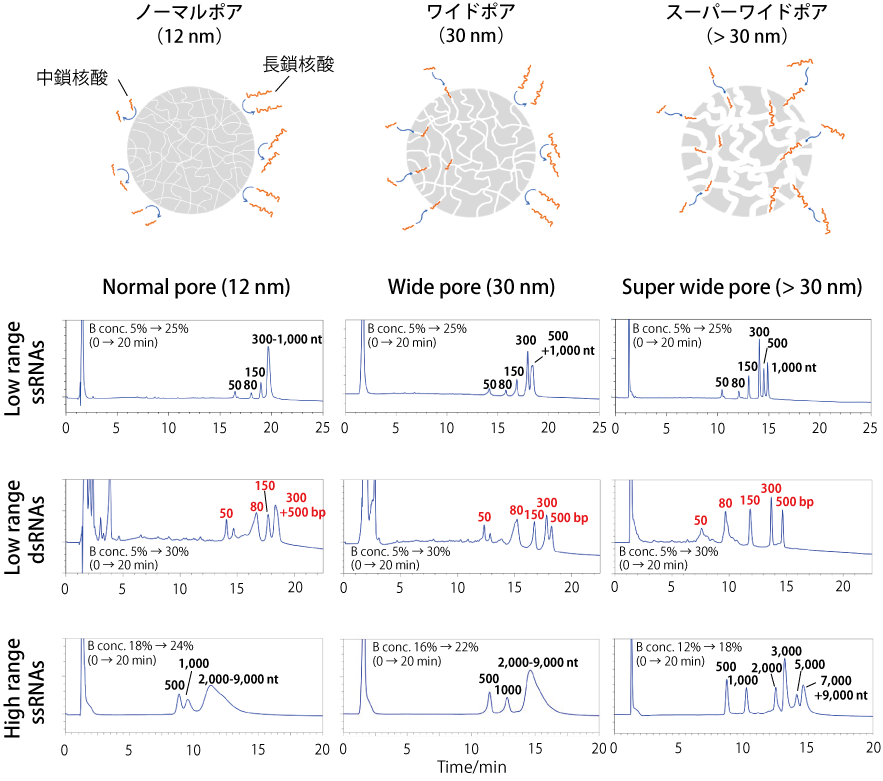
ノーマルポアとワイドポア、スーパーワイドポアを有する 3 種類の充填剤を用いて、さまざまな鎖長の ssRNA および dsRNA を分析し、核酸の鎖長とそれに適応する充填剤の細孔径を調べました。
| Conditions | |||
|---|---|---|---|
| Column | COSMOSIL RNA-RP1 type columns* 2.0 mm I.D. × 100 mm |
Flow rate | 0.2 mL/min |
| Mobile phase | A : 100 mM TEAA + 20 mM PB (pH 7.0) B : mobile phase A / MeCN (50/50, v/v) |
Temperature | ssRNAs : 65℃, dsRNAs : 40℃ |
| Detection | UV 260 nm | ||
*コスモシール RNA-RP1 と同じ合成法で作製した細孔径 12 nm、30 nm の充填剤を用いています。
- Low Range ssRNAs において、ノーマルポアでは 50 ~ 150 nt が分離しましたが、300 ~ 1,000 nt のピークが完全に重なりました。ワイドポアでは 50 ~ 300 nt は分離しましたが、500 nt と 1,000 nt は分離できませんでした。一方、スーパーワイドポアでは 50 ~ 1,000 nt の全ての ssRNAs を分離することができました。
- Low Range dsRNAs において、ノーマルポアでは 150 bp 以上のフラグメントが分離しませんでした。ワイドポアでは 300 bp と 500 bp が分離しませんでした。一方、スーパーワイドポアでは 50 ~ 500 bp の全てのピークが分離しました。
- High Range ssRNAs において、ノーマルポアでは 500 nt と 1,000 nt の分離が悪く、2,000 nt 以上は分離しませんでした。ワイドポアでは 500 nt と 1,000 nt は分離しましたが、2,000 nt 以上では分離しませんでした。スーパーワイドポアでは 5,000 nt までの ssRNAs を良好に分離することができました。
スーパーワイドポアの充填剤を用いたコスモシール RNA-RP1 カラムを使用することで、数百 ~ 数千 nt の ssRNA および数百 bp の dsRNA を良好に分離することができました。
ノーマルポアカラムを用いた短鎖核酸の分析結果
短鎖核酸の分離には、細孔径 8 ~ 13 nm 程度のノーマルポアカラムが汎用されています。そこで、ノーマルポアカラムを用いて短鎖核酸の分離における最適な移動相を検討しました。
● ポリアデニル鎖ラダー(10 ~ 50 nt)
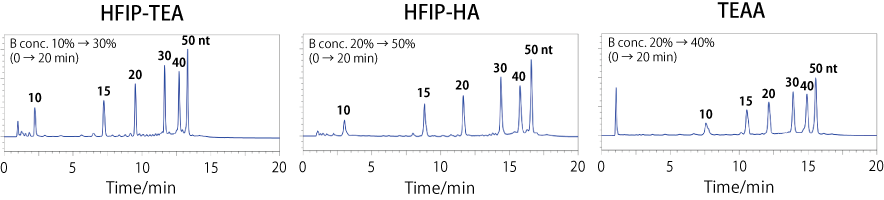
ノーマルポアをもつコスモコア 2.6C18 カラムにおけるポリアデニル鎖(poly d(A))ラダーの分析を、3 種類の移動相を用いて検討しました。
| Conditions | |||
|---|---|---|---|
| Column | COSMOCORE 2.6C18 2.1 mm I.D. × 100 mm | Flow rate | 0.2 mL/min |
| Mobile phase | HFIP-TEA : A ; 100 mM HFIP + 15 mM TEA, B ; mobile phase A / MeCN / MeOH (50/25/25, v/v/v) HFIP-HA : A ; 100 mM HFIP + 15 mM HA, B ; MeCN / MeOH (50/50, v/v) TEAA : A ; 100 mM TEAA, B ; mobile phase A / MeCN / MeOH (50/25/25, v/v/v) |
Temperature | 65℃ |
| Detection | UV 260 nm | ||
HFIP を含有する移動相では TEAA よりも良好な分離パターンを示すことが分かりました。また、アミンの種類において、トリエチルアミン(TEA)と n-ヘキシルアミン(HA)で分離パターンは大きく変わりませんでしたが、TEA の方がわずかに良い分離を示しました。なお、グラジエント勾配は各移動相条件で分離パターンが同程度になるように調整しています。
● S 化オリゴヌクレオチド(18 ~ 20 nt)
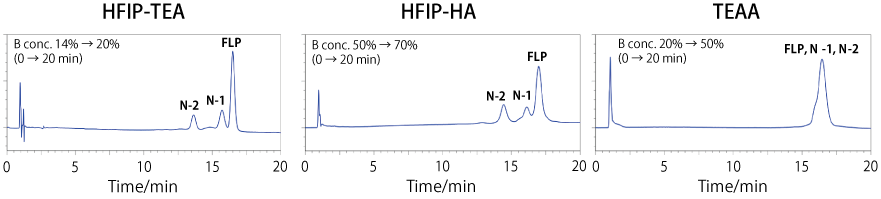
アンピシリン耐性遺伝子(Ampr)を基に設計した 18 mer(N-2)、19 mer(N-1)、20 mer(FLP)のオリゴヌクレオチドの全てのホスホジエステル結合をホスホロチオアート結合に変更して合成しました。これらの核酸をコスモコア 2.6C18 カラムで分析し、最適な移動相を調べました。なお、サンプルの配列情報は論文1)をご参照ください。
| Conditions | |||
|---|---|---|---|
| Column | COSMOCORE 2.6C18 2.1 mm I.D. × 100 mm | Flow rate | 0.2 mL/min |
| Mobile phase | HFIP-TEA : A ; 100 mM HFIP + 15 mM TEA, B ; mobile phase A / MeCN / MeOH (50/25/25, v/v/v) HFIP-HA : A ; 100 mM HFIP + 15 mM HA, B ; mobile phase A / MeCN / MeOH (50/25/25, v/v/v) TEAA : A ; 100 mM TEAA, B ; mobile phase A / MeCN / MeOH (50/25/25, v/v/v) |
Temperature | 65℃ |
| Detection | UV 260 nm | ||
各移動相条件において、得られるピーク幅が同程度になるようにグラジエント条件を調節して分析したところ、HFIP に TEA を混合した移動相(HFIP-TEA)で最も良い分離が得られました。HFIP に HA を混合した移動相(HFIP-HA)では、ピークトップはよく分離しましたが、ピークがブロードになっていることが分かりました。また、TEAA では全てのピークが重なり、分離しませんでした。
短鎖核酸の分離において、移動相 A は TEAA よりも HFIP がよく、また S 化オリゴについては HFIP-HA よりも HFIP-TEA の方が分離が良いことが分かりました。
※サンプルによってはほかのアミンを使用した方が良い結果を示すことがあります。
スーパーワイドポアカラムを用いた中鎖核酸の分析結果
核酸の鎖長が長くなると、分子サイズが大きくなり、ノーマルポアカラムの細孔には核酸が入りづらくなります。この問題を解決するために、細孔径 30 nm を超えるスーパーワイドポアを持つ C18 カラムであるコスモシール RNA-RP1 カラムを用いて、中鎖核酸を分析しました。
● in vitro 転写で合成した ssRNA
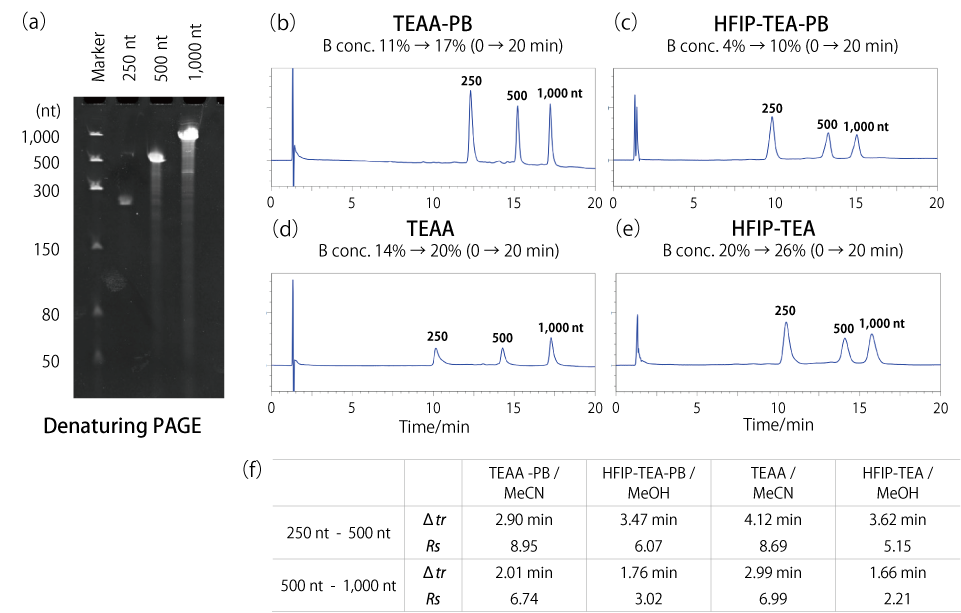
λDNA の配列を基に設計したコンストラクトを用いて、in vitro 転写により、250 nt と 500 nt、1,000 nt の 3 種類の ssRNA を合成しました。それぞれの ssRNA をコスモシール RNA-RP1 カラムで分析し、最適な移動相を調べました。
| HPLC conditions | |||
|---|---|---|---|
| Column | COSMOSIL RNA-RP1 2.0 mm I.D. × 100 mm | Flow rate | 0.2 mL/min |
| Mobile phase | TEAA-PB : A ; 100 mM TEAA + 20 mM PB (pH 7.0), B ; mobile phase A / MeCN (50/50, v/v) HFIP-TEA-PB : A ; 100 mM HFIP + 15 mM TEA + 20 mM PB (pH 8.5), B ; mobile phase A / MeOH (50/50, v/v) TEAA : A ; 100 mM TEAA, B ; mobile phase A / MeCN (50/50, v/v) HFIP-TEA : A ; 100 mM HFIP + 15 mM TEA, B ; mobile phase A / MeOH (50/50, v/v) |
Temperature | 65℃ |
| Detection | UV 260 nm | ||
in vitro 転写で合成したそれぞれの ssRNA を尿素変性 PAGE で分析したところ、鎖長 250 nt、500 nt、1,000 nt のいずれにおいても高い純度で合成できていることが確認されました[(a)]。クロマトグラムの溶出時間の差(Δtr)と分離度(Rs)の数値より、中鎖核酸の分離における移動相は HFIP よりも TEAA の方が好ましく、また中でもリン酸を含む TEAA(TEAA-PB / MeCN)で最も良いピーク形状を示すことが分かりました[(b)~(f)]。
RNA を取り扱う際の注意点
- RNA は RNase や熱への耐性が低いため、取り扱う際は手袋を着用し、氷上で操作を行ってください。サンプルの希釈や HPLC 装置へのセットの際も同様です。
- RNA はガラスに吸着しやすいため、サンプル溶液はガラス製のバイアルではなく、プラスチック製のチューブなどに保存することを推奨します。
- RNA は機械的強度が低いため、過度なピペッティングは避けてください。
分析時の注意点
- 購入した新しいカラムを使用される際は、RNA の吸着を防ぐために、リン酸緩衝液をカラムに十分に通液してください。その後、標準サンプルを分析し、分離パターンやピーク形状が安定していることを確認してから、実サンプルを分析してください。
● in vitro 転写で合成した核酸の不純物分離と分取精製時の注意点
in vitro 転写で合成した 500 nt の ssRNA を尿素変性 PAGE で分析したところ、不純物と思われるバンドは確認されませんでした。一方、同サンプルを HPLC で分析したところ、不純物に由来すると考えられるいくつかのピークが確認されました。
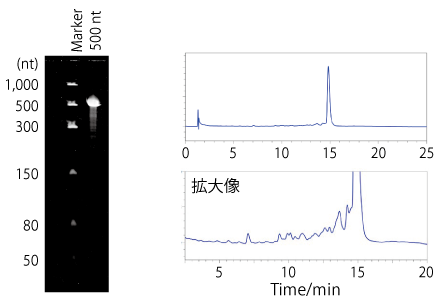
合成した核酸を生体内投与する場合など、分取精製により、不純物成分を可能な限り除去することが好ましいと考えられます。
分取精製の概要図
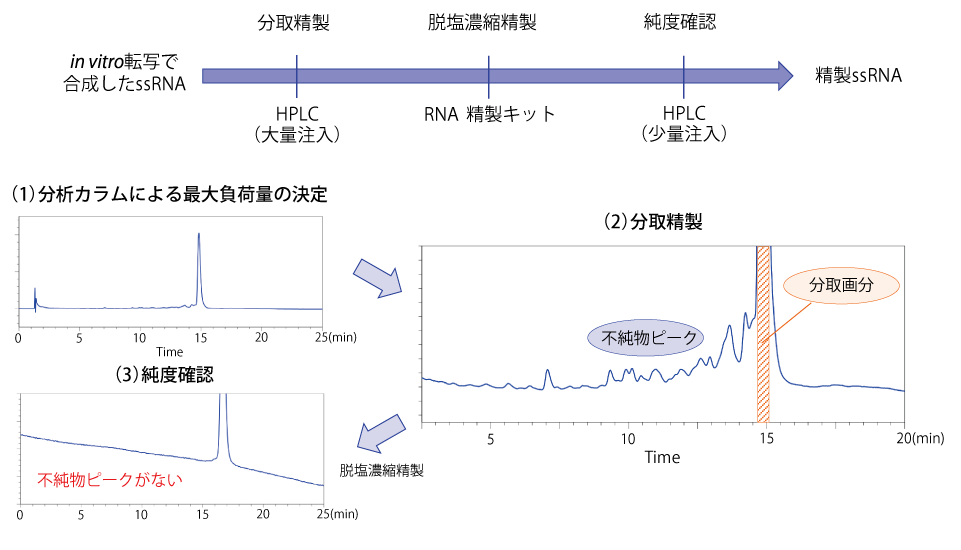
分取のポイント
- 分取精製する際は、まず分析カラムでサンプルを徐々に増やして分析し、安定してピークが溶出するか確認して最大負荷量を決定します。目的物と不純物の分離ができ、かつ安定したピーク形状を示す精製条件を確立してください。
- 決定した精製条件で分取を行います。このとき、不純物ピークまで分取してしまうと純度が低下するため、なるべく不純物ピークを混入させないように分取します。また、ピークの両裾を分取すると、ピークとして分離していない不純物を分取する可能性がありますので、両裾も取らないようにしてください。
- 分取したサンプルは、不純物が除去できているか純度確認を行ってください。
分取精製時の注意点
- 分取精製の前に、少量のサンプルを用いて目的物と不純物の溶出位置およびピーク形状が安定していることを確認してください。
- 平衡化時間が短いと、分析ごとに溶出時間が変化してしまうため、平衡化時間はカラム長 100 mm のカラムで 15 分程度取るようにし、短縮しないでください。(なお、装置のミキサー容量によって、平衡化時間は変化します。)
- 負荷量はサンプルによって異なるため、注入量の検討を行ってから精製を実施してください。
- 核酸がガラスに吸着するのを防ぐため、プラスチック製のチューブなどを使用して分取してください。
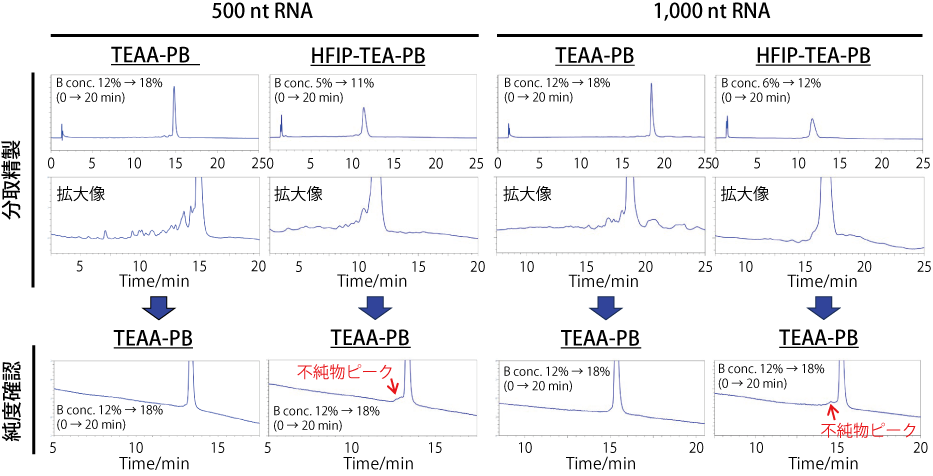
● in vitro 転写で合成した中鎖 ssRNA 中の不純物分離と分取精製
| Conditions | |||
|---|---|---|---|
| Column | COSMOSIL RNA-RP1 2.0 mm I.D. × 100 mm | Flow rate | 0.2 mL/min |
| Mobile phase | TEAA-PB : A ; 100 mM TEAA + 20 mM PB (pH 7.0), B ; mobile phase A / MeCN (50/50, v/v) HFIP-TEA-PB : A ; 100 mM HFIP + 15 mM TEA + 20 mM PB (pH 8.5), B ; mobile phase A / MeOH (50/50, v/v) |
Temperature | 65℃ |
| Detection | UV 260 nm | ||
500 ng の 500 nt と 1,000 nt の ssRNA を TEAA-PB および HFIP-TEA-PB を用いて分取精製したところ、TEAA-PB では目的物由来のピークがシャープであり、また不純物だと考えられるピークが多数確認されました。一方、HFIP-TEA-PB ではピーク形状がブロードであり、TEA-PB と比較すると不純物由来と考えられるピークがほとんど確認されませんでした。以上の結果から、中鎖核酸中の不純物の分離において、移動相 A は HFIP-TEA-PB よりも TEAA-PB の方が適していることが示唆されました。
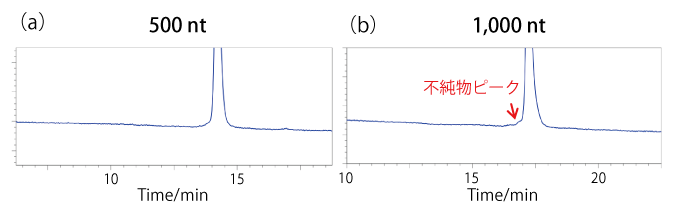
● in vitro 転写で合成した ssRNA の分析に適した有機溶媒種の検討
数千 nt 以上の長鎖核酸においては、アセトニトリルとメタノールの混合溶液を有機溶媒に用いると分離が良くなることが示されています2)。移動相 A に TEAA-PB、移動相 B にアセトニトリルを用いて分取精製した 500 nt と 1,000 nt の ssRNA を RNA 精製キットで脱塩濃縮精製した後、有機溶媒種をアセトニトリルからアセトニトリルとメタノールの混合溶液に変更して、純度確認を行いました。
| Conditions | |||
|---|---|---|---|
| Column | COSMOSIL RNA-RP1 2.0 mm I.D. × 100 mm | Flow rate | 0.2 mL/min |
| Mobile phase | A : 100 mM TEAA B : mobile phase A / Acetonitrile / Methanol (50/25/25, v/v/v) B conc. 16% → 22% (0 → 20 min), Linear gradient |
Temperature | 65℃ |
| Detection | UV 260 nm | ||
500 nt の ssRNA は純度よく精製できていましたが[(a)]、1,000 nt の ssRNA では、有機溶媒種がアセトニトリルのときには検出されなかった不純物由来と考えられるピークが確認されました[(b)]。このことから、中鎖核酸においても 1,000 nt 程度まで鎖長が長くなると、有機溶媒にはアセトニトリルとメタノールの混合溶液を使用した方が良いことが分かりました。
1,000 nt 程度以上の鎖長の ssRNA においては移動相の有機溶媒にアセトニトリルとメタノールの混合溶液を使用する必要があることが示されました。
● 中鎖核酸の分析に適した移動相のまとめ
以上の実験より、中鎖核酸は長さによって、分離に最適な有機溶媒が異なることが分かりました。
| 核酸鎖長 | 水系移動相 | 有機溶媒系移動相 |
|---|---|---|
| 100 nt ~ 500 nt 程度 | TEAA-PB | MeCN |
| 500 nt ~ 1,000 nt 程度 | MeCN + MeOH 混合溶液 |
スーパーワイドポアカラムを用いた長鎖核酸の分析結果
長鎖核酸の分析方法については、弊社の先行研究に詳細がありますので、ご参照ください。本資料では、先行研究で説明されていない分取精製のデータを掲載しています。
● in vitro 転写で合成した ssRNA の分取精製と純度確認
pQBI-T7-GFP ベクターの塩基配列を基に、in vitro 転写で 4.8 knt の ssRNA を合成しました。この ssRNA を尿素変性 PAGE および逆相 HPLC で分析し、純度確認を行いました。その後、逆相 HPLC でメインピークを分取、RNA 精製キットで脱塩濃縮を行った後に、再度逆相 HPLC で分析し、純度確認を行いました。

| HPLC conditions | |||
|---|---|---|---|
| Column | COSMOSIL RNA-RP1 2.0 mm I.D. × 100 mm | Flow rate | 0.2 mL/min |
| Mobile phase |
A : 100mM TEAA + 20 mM PB (pH 7.0) B : MeCN/ MeOH (50/50, v/v) B conc. 11% → 13% (0 → 20 min), Linear gradient |
Temperature | 60℃ |
| Detection | UV 260 nm | ||
in vitro 転写で合成した 4.8 knt の ssRNA を尿素変性 PAGE で分析したところ、不純物は確認されませんでした[(a)]。同サンプルを HPLC で分析したところ、メインピークのほかに不純物由来と考えられる複数のピークが確認されました[(c)]。メインピークを分取し[(b)]、脱塩精製したサンプルを再度 HPLC で分析したところ、不純物由来と考えられるピークは消失していました[(d)]。以上の結果から、尿素変性 PAGE では分離が難しい不純物を HPLC では分離可能であることが示されました。
核酸の鎖長と適した充填剤の細孔径および移動相
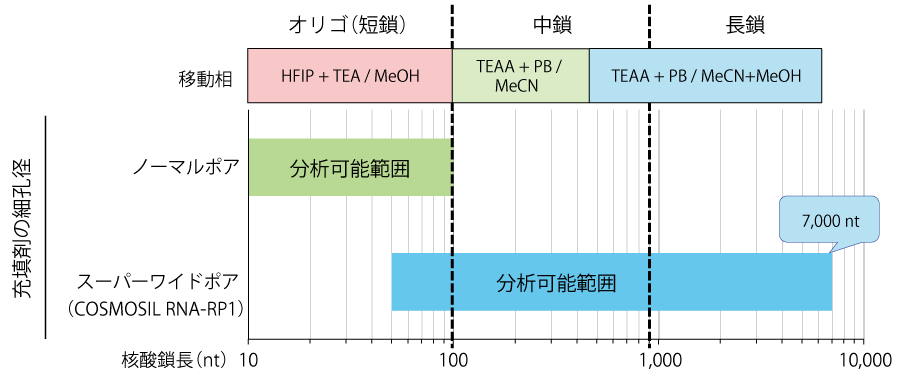
本研究における ssRNA の分析結果より、短鎖・中鎖・長鎖の各核酸鎖長に適した移動相と細孔径は上図のようになりました。
参考文献
- 1)Ozaki M, Kuwayama T, Shimotsuma M, Hirose T. Anal. Methods. 2024;16:1948-1956.
https://doi.org/10.1039/D4AY00114A
※ Featured on Front Cover - 2)Kuwayama T, Ozaki M, Shimotsuma M, Hirose T. Anal. Sci. 2023;39:417-425.
https://doi.org/10.1007/s44211-022-00253-w
※ Selected as Hot Articles 2023 - 3)尾崎 誠, 桑山 知美, 下間 志士, 廣瀬 恒久
Medical Science Digest, Vol.49, 12 月臨時増刊号 核酸医薬が飛躍する時

Analytical Methods 誌 の Front Cover に掲載されたカバーアートと Analytical Sciences 誌に選定された Hot Articles 2023 の賞状
価格表
本研究の関連製品情報
*本研究で使用したカラム
COSMOSIL / コスモシール、COSMOCORE / コスモコアはナカライテスク株式会社の登録商標です。
関連製品
※掲載内容は予告なく変更になる場合があります。

