LifeSensors 社 ユビキチンおよびユビキチン様タンパク質研究試薬
細胞の機能調節において、ユビキチン(Ub)およびユビキチン様タンパク質(UbL)によるタンパク質の翻訳後修飾は、大変重要な役割を果たしています。LifeSensors 社では、さまざまなユビキチンおよびユビキチン様タンパク質研究用試薬を販売しています。

- イソペプチダーゼ基質(ジユビキチン化 IQF 基質)
- イソペプチダーゼ基質(ユビキチン / UbL 誘導体)
- イソペプチダーゼアッセイ
- ユビキチン KR 変異体
- ユビキチン-プロテアソーム系阻害剤
- Ub 修飾酵素
- ユビキチン / UbL イソペプチダーゼ
イソペプチダーゼ基質(ジユビキチン化 IQF 基質)
脱ユビキチン化酵素(DUB)のユビキチン鎖(K48、K63)に対するイソペプチダーゼ活性を測定するための基質で、アゴニストやアンタゴニストのアッセイに最適です。
特長
- 生理条件に最も適した DUB 基質
- DUBの最適条件検討用に結合型/蛍光体の位置について多様な組み合わせをご用意
- 真のイソペプチド結合切断活性の測定
- ハイスループット対応(96 および 384 ウェル形式で実証済み)
- 蛍光体の位置は N 末端や C 末端(ユビキチン構造に影響を与えることが知られている位置)以外
原理
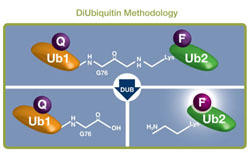
LifeSensors 社の IQF-DiUb 基質は、イソペプチド結合の切断を連続してモニタリングできる脱ユビキチン化酵素基質として市場で最初に発売されました。これは、1 つのユビキチンに蛍光体、他方のユビキチンにクエンチャーをそれぞれ組み込んだ内部消光蛍光(IQF)分子を作成することにより実現しました。ユビキチン間
のイソペプチド結合が切断されると、クエンチャーと蛍光体が分離して蛍光が増加します。ユビキチン構造に与える影響を最小に抑えるため、蛍光体とクエンチャーは、N 末端や C 末端ではなくユビキチン分子内の特定の部位に結合されています。標識部位によっては DUB による認識に影響を与えるため、各結合について標識部位が異なる複数種類のジユビキチン基質が一緒になっているパネルをご用意しています。たとえば、LifeSensors 社の K48 結合ジユビキチンについては 6 種類あります。まずはジユビキチンパネルを用いて、目的結合型のどの種類を使えばお客様のアッセイ条件において最適な結果を得られるのか検討することをお薦めします。
使用例
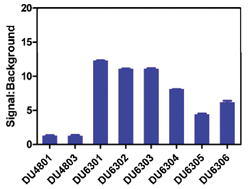
DUB である AMSH core の活性を DiUb48 または DiUb63 のバリアントを用いて測定した。DUB 不含のものをバックグラウンドとしてシグナル:バックグラウンドを算出した。その結果、K63 のバリアント 1(DU6301)に対して高い活性を示した。
価格表
*1 DiUb 48-1、DiUb 48-2、DiUb 48-3、 DiUb 48-4、DiUb 48-5、 DiUb 48-6 各 25 µL(20 µM)がセットになっています。
*2 DiUb 63-1、DiUb 63-2、DiUb 63-3、 DiUb 63-4、DiUb 63-5、 DiUb 63-6 各 25 µL(20 µM)がセットになっています。
イソペプチダーゼ基質(ユビキチン / UbL 誘導体)
LifeSensors 社では、イソペプチダーゼアッセイにおいて、妨害物質となる遊離のユビキチンや蛍光物質フリーの高純度の蛍光標識基質および阻害剤を販売しています。
特長
- 妨害物質となる遊離の蛍光色素やタンパク質フリー
使用例
LifeSensors 社 Ub-AMC と A 社Ub-AMC との比較
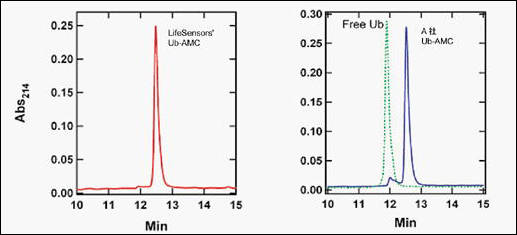
LifeSensors 社の Ub-AMC(データ左側の赤線)と A 社製品の Ub-AMC(データ右側の青線)の等量を C18 カラムにより RP-HPLC 解析を行った。リファレンスには、遊離のユビキチンのプロファイルが示されている(データ右側の緑線)。 LifeSensors 社の Ub-AMC は、ユビキチンアッセイの妨害物質となる遊離のユビキチンを含みません。
価格表
AMC 誘導体の(Ex / Em)= 380 / 400、Rhodamine 誘導体の(Ex / Em)= 485 / 535
イソペプチダーゼアッセイ
CHOP レポーターシステムは、in vitro でのイソペプチダーゼ活性を迅速・簡便に検出するアッセイシステムです。
従来の酵素活性基質を用いたアッセイ法よりも高感度な測定が可能な新しいアッセイシステムです。
特長
- 従来法の蛍光基質と比較し低バックグラウンドで高感度
- アッセイに必要な時間はわずか 30 分
原理
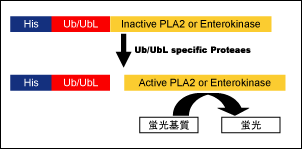
本アッセイで使用する基質は、レポーター酵素[PLA2(CHOP シリーズ)もしくはエンテロキナーゼ(CHOP2 シリーズ)]と Ub / UbL と複合体を形成しています。この基質が Ub / UbL プロテアーゼにより基質が分解されると、複合体のレポーター酵素が活性化され、これらに対する蛍光基質と反応させると蛍光を発します。この値を測定することで Ub / UbL プロテアーゼの活性の高感度測定が可能です。
レポーターの違いにより、CHOP と CHOP2 の 2 種類を用意しています。CHOP2 シリーズは、CHOP シリーズと比較し、 長時間のインキュベーション(6 時間以上)や各種界面活性剤を含むアッセイ系への適応が可能です。
使用例
従来法との比較
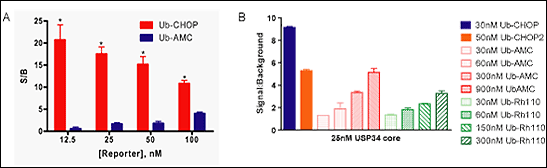
A:Ub-CHOP は従来の蛍光基質 Ub-AMC と比較し、高感度かつ低バックグランドで検出することが可能です。
B:Ub-CHOP および Ub-CHOP2 は従来の蛍光基質 Ub-AMC や Ub-Rh110 と比較し、高感度かつ低バックグラウンドで検出することが可能です。
参考文献
PLA2 を利用したアッセイシステムの技術文献は、以下をご参照ください。
Nicholson, B., Leach, C.A., et al. Characterization of ubiquitin and ubiquitin-like-protein isopeptidase activities.
Protein Sci. 2008, vol. 17, no. 6, p. 1035-1043.
価格表
CHOP2 の(Ex / Em)= 472 / 552、CHOP の(Ex / Em)= 485 / 531
ユビキチン KR 変異体
ユビキチンは、その C 末端を介して、標的タンパク質のリジン残基へ連結されます(モノユビキチン化)。ユビキチンには 7 つのリジン残基があり、標的タンパク質に連結しているユビキチンのリジン残基へ、更にユビキチンが連結することができます(ポリユビキチン化)。LifeSensors 社では、ユビキチン中の 7 つのリジンの内 1 つ、2 つ、6 つあるいは 7 つ全てをアルギニンに置換したユビキチンを販売しています。
価格表
由来:Human Recombinant
ユビキチン-プロテアソーム系阻害剤
LifeSensors 社は、ユビキチン-プロテアソーム系のさまざまな部分の機能を解明するために必要な阻害剤を多数提供しています。ユビキチンビニルメチルエステルやユビキチンアルデヒドなどの反応型 Ub / UbL 誘導体を含む従来型の阻害剤に加えて、DUB やプロテアソームに対する小分子阻害剤も複数提供しています。最新の製品は、Ub / UbL 結合酵素の阻害剤です。
価格表
Ub 修飾酵素
ユビキチン修飾系は 3 つの酵素、ユビキチン活性化酵素 (E1)、ユビキチン結合酵素 (E2)、さらにユビキチン転移酵素(ユビキチンリガーゼ) (E3)の 3 種の酵素群の働きにより、標的タンパク質の分解、シグナル伝達や DNA 修復タンパク質の機能を制御します。LifeSensors 社ではユビキチン化アッセイに利用いただけるリコンビナントタンパク質を販売しています。
価格表
ユビキチン / UbL イソペプチダーゼ
脱ユビキチン化酵素(DUB)および UbL イソペプチダーゼは、ユビキチン(または UbL)間またはユビキチン(または UbL)と対象タンパク質の間のイソペプチド結合を認識し、これを切断する機能を有します。DUB は配列の相同性により、ユビキチン C 末端ヒドラーゼ(UCH)、ユビキチン特異プロテアーゼ(USP)、マシャドジョセフ病ドメインプロテアーゼ、Otubain プロテアーゼ(Otu)、および JAMM ドメインプロテアーゼの 5 つのクラスに分類されます。この他に、ウイルス由来の DUB、バクテリア由来の DUB、および UbL イソペプチダーゼ(Deneddylase / Desumoylase)があります。
価格表
※掲載されている内容は予告なく変更される場合があります。